A principal limitação da sobrevida a longo prazo após-transplante cardíaco é a doença vascular do aloenxerto que consiste na hiperplasia concêntrica e difusa da íntima arterial. A doença continua a ter uma incidência significativa estimada em 30% aos 5 anos pós-transplante cardíaco. Por ser uma doença clinicamente silenciosa, o seu diagnóstico é um desafio. A angiografia coronária complementada pela ecografia intravascular é o método de diagnóstico mais sensível. No entanto, novas técnicas de diagnóstico não invasivas podem vir a ter relevância clínica no futuro. O seu diagnóstico, o mais precocemente possível, é essencial de forma a permitir atrasar a progressão da doença a fim de melhorar o seu prognóstico. Em Julho de 2010, foi publicada uma nova nomenclatura recomendada para a vasculopatia do aloenxerto, elaborada pela Internacional Society for Heart and Lung Transplantation (ISHLT) e que permite uma uniformização da definição. Em simultâneo, foram publicadas as novas recomendações da ISHLT que procuram uma uniformização no diagnóstico e no manejo destes doentes. Este artigo faz uma revisão dos conceitos atuais da fisiopatologia, diagnóstico, prevenção e tratamento da vasculopatia do aloenxerto, realçando áreas em investigação.
The major limitation of long-term survival after cardiac transplantation is allograft vasculopathy, which consists of concentric and diffuse intimal hyperplasia. The disease still has a significant incidence, estimated at 30% five years after cardiac transplantation. It is a clinically silent disease and so diagnosis is a challenge. Coronary angiography supplemented by intravascular ultrasound is the most sensitive diagnostic method. However, new non-invasive diagnostic techniques are likely to be clinically relevant in the future. The earliest possible diagnosis is essential to prevent progression of the disease and to improve its prognosis. A new nomenclature for allograft vasculopathy has been published in July 2010, developed by the International Society for Heart and Lung Transplantation (ISHLT), establishing a standardized definition. Simultaneously, the ISHLT published new guidelines standardizing the diagnosis and management of cardiac transplant patients. This paper reviews contemporary concepts in the pathophysiology, diagnosis, prevention and treatment of allograft vasculopathy, highlighting areas that are the subject of ongoing research.
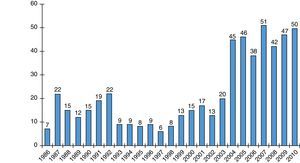
Apesar de atualmente termos ao nosso dispor uma grande variedade de terapêuticas farmacológicas e de intervenções eletrofisiológicas, como os dispositivos de ressincronização, a transplantação cardíaca continua a ser o tratamento gold standard para doentes com insuficiência cardíaca avançada refratários à terapêutica médica. O registo da Internacional Society for Heart and Lung Transplantation (ISHLT) reporta, desde 1983 até 2010, a realização de 89 000 transplantes cardíacos, estimando que, atualmente, o número de transplantados cardíacos em todo o mundo possa ultrapassar os 5 000 por ano1. Em Portugal o primeiro transplante cardíaco foi realizado em 19862–4. Segundo dados da Autoridade para os Serviços de Sangue e da Transplantação, nos últimos anos Portugal registou um progressivo aumento do número de transplantes cardíacos realizados, perfazendo um total de 558 doentes tratados até ao ano 20105 (ver Fig. 1). A sobrevida média após transplantação cardíaca aumentou progressivamente de 8,3 anos na década de 1980 para 10,4 anos na década de 1990, e cerca de 13 anos na atualidade. Esta melhoria reflete a diminuição da mortalidade no período precoce pós-transplante cardíaco, facto que pode ser devido a inúmeros fatores, entre eles, uma melhoria dos critérios de seleção do recetor e dador, melhor preservação do coração do dador e introdução da ciclosporina no início dos anos 1980, que veio revolucionar a terapêutica imunossupressora e a rejeição aguda do aloenxerto6. Pelo contrário, a mortalidade a longo prazo após o 1.° ano de transplantação cardíaca tem-se mantido relativamente constante e superior à população geral (3 a 4% por ano)1. Um dos grandes fatores limitativos da sobrevida a longo prazo após transplantação cardíaca continua a ser o desenvolvimento da doença vascular do aloenxerto (DVA) cardíaco7. Esta entidade, que é uma forma acelerada de doença coronária que se caracteriza por um progressivo espessamento da íntima arterial, é muito prevalente (8% a um ano, 20% a 3 anos, 30% aos 5 anos e mais de 50% aos 10 anos) e resulta numa significativa morbilidade e mortalidade1. De forma a uniformizar a definição da vasculopatia do aloenxerto (VA), foi publicado em Julho de 2010 um documento de consenso comissariado pela ISHLT7. Em simultâneo, foram elaboradas pela ISHLT as novas recomendações no tratamento do doente transplantado cardíaco (Guidelines for the care of heart transplant recipients), que incluem o manejo da DVA (Task force 3)8. Ambos os documentos procuram uma maior equidade no diagnóstico precoce desta doença para que sejam implementadas medidas de tratamento e prevenção adequadas. Este artigo faz uma revisão dos conceitos atuais de fisiopatologia, diagnóstico, prevenção e tratamento da VA, realçando áreas em investigação.
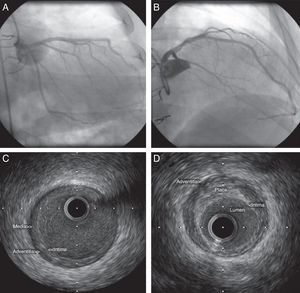
FisiopatologiaAs características patológicas da DVA diferem significativamente da doença coronária aterosclerótica típica (Tabela 1). A DVA consiste na proliferação concêntrica da íntima arterial que resulta no seu espessamento e no remodeling patológico, que, em conjunto, contribuem para um progressivo estreitamento do lúmen arterial9. Esta forma de vasculopatia caracteriza-se por um envolvimento preferencial de pequenas e médias artérias de um modo difuso e concêntrico10–11. Os vasos intramiocárdicos, assim como as veias, são frequentemente envolvidos, raramente há depósitos de cálcio, a lâmina elástica interna permanece intacta e pode ocorrer inflamação com aumento da espessura da íntima por células inflamatórias mononucleares infiltradas12. No entanto, numa fase muito precoce após-transplante podem ser detetadas placas excêntricas transmitidas pelo dador. Do mesmo modo, numa fase tardia pós-transplante podem ser visualizadas placas ateroscleróticas típicas que se misturam com o espessamento difuso da íntima, próprio da DVA13,14. Na Figura 2 podem ser visualizados por ecografia intracoronária 2 tipos diferentes de placas num mesmo doente transplantado há cinco anos com angiografia coronária atual, aparentemente normal.
Diferenças entre a DVA e a doença coronária aterosclerótica
| Característica | Vasculopatia do aloenxerto | Doença coronária aterosclerótica |
| Localização | Vasos epicárdicos distais e intramiocárdicos | Vasos epicárdicos proximais |
| Tipo de placa | Difusa, concêntrica | Focal, excêntrica |
| Inflamação | Sim | Raramente |
| Vasculite | Infrequente | Nunca |
| Lâmina elástica interna | Intacta | Disrupta |
| Depósito de cálcio | Não | Sim |
Imagens de ecografia intracoronária da descendente anterior referentes a um doente transplantado cardíaco há 5 anos que apresentou simultaneamente o espessamento concêntrico da íntima típico da DVA (C) e uma placa excêntrica típica da doença coronária aterosclerótica clássica (D). A angiografia coronária não foi sugestiva de doença na artéria descendente anterior (A e B).
A VA é uma doença complexa com múltiplas etiologias possíveis e que incluem fatores imunológicos e não imunológicos15. Assim, a doença vascular acelerada do aloenxerto é o resultado de uma resposta inflamatória local e sistémica contínua com a consequente lesão do endotélio vascular repetitiva e que é iniciada por fatores dependentes do aloantigénio e por fatores de stress não imunológicos16,17. Num trabalho de Raichlin et al.16, a presença de artérias coronárias com placas inflamatórias (core necrótico e pontos de calcificação densa) detetadas por ecografia intracoronária com histologia virtual, estiveram associadas a rejeição recorrente precoce com a subsequente progressão para VA. Este estudo confirmou a associação entre a rejeição celular recorrente precoce e o desenvolvimento de placas inflamatórias suportando a base imunológica para o processo inflamatório. Adicionalmente, realçou a importância da inflamação local em todo o processo de disfunção endotelial. Muitos outros estudos recentes têm mostrado que a inflamação sistémica também contribui para o desenvolvimento desta forma de vasculopatia acelerada. A Proteína C Reactiva (PCR) de alta sensibilidade, que é um dos marcadores mais sensíveis de inflamação sistémica, está frequentemente elevada nos doentes que desenvolvem DVA e é preditora de rejeição tardia17–21. Alguns autores sugerem que a disfunção endotelial pode representar uma fase precoce e potencialmente reversível da VA22–23. A perturbação da produção de óxido nítrico endotelial e o aumento da produção de endotelina parecem favorecer o desenvolvimento de aterogénese ao induzirem vasoconstrição24–25.
Em relação aos potenciais fatores imunológicos, sabe-se que as células endoteliais expressam antigéneos das classes I e II do complexo de histocompatibilidade major (HLA) que constituem os alvos da resposta imune humoral e mediada por células15,26. Os linfócitos T ativados secretam citoquinas (interleucinas, interferão e fator de necrose tumoral), que são responsáveis por recrutar monócitos ativados e macrófagos e estimular a produção de moléculas de adesão pelo endotélio27. Os macrófagos recrutados pelo endotélio produzem citoquinas e fatores de crescimento que conduzem à proliferação de células musculares lisas e síntese de matrix extracelular28. São também encontrados anticorpos circulantes anti-HLA e contra o endotélio do doador num número significativo de transplantados cardíacos, sendo que a sua presença está associada a pior prognóstico, reforçando a hipótese de que a resposta imuno-humoral também pode ter um papel na patogénese da VA29–32.
Os fatores de risco não imunológicos identificáveis incluem a idade do dador e do recetor1, a causa de morte cerebral33, a lesão de isquémia e reperfusão34, infeções virais35–36 e distúrbios metabólicos37. A presença de aterosclerose coronária no coração do dador não contribui para uma mais rápida progressão da hiperplasia da íntima e não parece afetar a sobrevida a longo prazo do recetor, num estudo publicado previamente com um seguimento por ecografia intravascular a três anos38. Os fatores de risco cardiovasculares clássicos como a hipertensão, a dislipidemia e a diabetes são frequentemente mais prevalentes na população de transplantados cardíacos do que na população geral, em grande parte resultado da terapêutica imunossupressora necessária para evitar a rejeição de órgão39. De facto, a dislipidemia e a resistência à insulina são os fatores não imunológicos que mais contribuem para o desenvolvimento da vasculopatia, porque são muito prevalentes (ocorrem em cerca de 50-80% da população de transplantados cardíacos)37,40.
DiagnósticoAngiografiaO diagnóstico da DVA continua a ser um desafio para o clínico. Por ser uma doença que é clinicamente silenciosa, devido à desenervação do aloenxerto, eventos cardiovasculares major, como enfarte do miocárdio, insuficiência cardíaca ou morte súbita, podem ocorrer sem pródromos de angina41. O facto de ser uma vasculopatia com atingimento dos vasos de forma difusa dificulta a utilização de métodos não invasivos, que se baseiam na deteção de lesões coronárias com obstruções limitativas de fluxo para o seu diagnóstico precoce42. Em muitos centros de transplante cardíaco, a angiografia coronária é o método usado para o diagnóstico de DVA. O estudo de Costanzo43 foi um estudo de grandes dimensões que incluiu 5 693 doentes de vários centros submetidos a rastreio da VA por coronariografia clássica. A doença coronária esteve presente em 42% dos doentes após cinco anos de transplante cardíaco. Nos doentes com vasculopatia documentada como grave, 50% morreram ou foram retransplantados. O esquema de classificação para a VA usado neste estudo mostrou utilidade na discriminação do prognóstico e, por isso, foi adaptado para a elaboração da nova definição da VA, publicada num documento de consenso comissariado pela ISHLT7 (Tabela 2).
Nomenclatura recomendada para a vasculopatia do aloenxerto
| ISHLT CAV0 (Não significativa) | Sem lesão angiográfica detetável |
| ISHLT CAV1 (Ligeira) | Tronco comum com estenose angiográfica < 50%, vaso principal < 70% ou estenose de qualquer vaso secundário < 70%, sem disfunção do aloenxerto |
| ISHLT CAV2 (Moderada) | Tronco comum com estenose ≥ 50%; vaso principal com estenose isolada ≥70% ou estenose de vaso secundário ≥ 70% em ramos de 2 territórios arteriais, sem disfunção do aloenxerto |
| ISHLT CAV3 (Grave) | Tronco comum com estenose ≥ 50%, ou 2 ou mais vasos principais com estenose ≥ 70% ou estenose de vaso secundário ≥ 70% nos 3 territórios arteriais; ou ISHLT CAV1 ou CAV2 com disfunção do aloenxerto (definida como fração de ejeção ventricular esquerda ≤ 45% habitualmente na presença de alterações segmentares) ou evidência de fisiologia restritiva |
Fonte:7.
Fisiologia cardíaca restritiva: insuficiência cardíaca sintomática com padrão ecocardiográfico restritivo (E/A > 2, tempo de relaxamento isovolumétrico < 60 mseg, tempo de desaceleração < 150 mseg) ou padrão hemodinâmico restritivo (pressão aurícula direita > 12mmHg, pressão capilar pulmonar > 25mmHg, índice cardíaco <2l/min/m2); Vaso secundário: 1/3 do segmento distal da artéria descendente anterior, diagonais, obtusas marginais ou qualquer segmento de uma artéria coronária direita não dominante; Vaso principal: artéria descendente anterior proximal até 1/3 do segmento médio; artéria circunflexa, ramo intermediário e artéria coronária direita dominante ou codominante e inclui a descendente posterior e ramos póstero-laterais.
Embora a angiografia seja o método de rastreio anual proposto, a sua sensibilidade na deteção da doença coronária do enxerto cardíaco é baixa (apresenta um valor preditivo positivo de apenas 44% quando comparada com a ecografia intravascular (IVUS) considerada o gold standard)44,45. A angiografia clássica não permite avaliar a parede arterial e, o remodeling vascular que ocorre com o desenvolvimento da vasculopatia pode obscurecer a sua deteção pela angiografia46. Para ultrapassar estas limitações, temos ao dispor a ecografia intravascular que é atualmente reconhecida como o método diagnóstico mais sensível para a deteção precoce da VA47. A avaliação da espessura máxima da íntima deve ser avaliada por pullback automático num ou mais vasos epicárdicos ao longo de um segmento de 40 a 50mm7. De realçar que um espessamento da íntima arterial > 0,5mm no primeiro ano pós-transplante cardíaco constitui um marcador de risco de eventos cardiovasculares major não fatais e mortalidade e prediz o desenvolvimento de VA nos cinco anos seguintes41,48. Deste modo, a ecografia intravascular poderia ser usada para avaliar o risco de desenvolver a doença, definir o prognóstico e orientar a terapêutica, mas esta indicação não está ainda consolidada7. De acordo com as recomendações atuais da ISHLT8, a coronariografia clássica deve ser realizada com uma periodicidade anual ou bianual, de forma a monitorizar o desenvolvimento da DVA. Os transplantados cardíacos que não desenvolvem vasculopatia nos primeiros três a cinco anos podem ser selecionados para uma avaliação invasiva menos frequente, principalmente se tiverem insuficiência renal. A ecografia intravascular realizada quatro a seis semanas após-transplante cardíaco pode ser útil quando há suspeita de doença coronária no dador (idade > 35 anos), mas é obviada na maior parte dos centros. A ecografia intravascular no primeiro ano pós-transplante cardíaco é de extrema utilidade e pode ser uma opção, uma vez que permite a deteção da DVA rapidamente progressiva e fornece informação prognóstica. Se o transplantado cardíaco for submetido a angioplastia percutânea, recomenda-se o seguimento por coronariografia após seis meses devido à alta taxa de reestenose neste contexto8.
Avaliação da função endotelial e microvascularA DVA pode atingir não só a circulação epicárdica como a microcirculação e, por isso, têm sido desenvolvidos testes de avaliação da função microvascular, nomeadamente, a avaliação da reserva coronária49 e das resistências microvasculares50 por termodiluição. O estudo PITA49 mostrou, por um lado, que o flow fractional reserve (FFR) avaliado através de um fio de pressão ligado a um transdutor se correlaciona com os achados da ecografia intravascular, sugerindo que as alterações difusas da árvore coronária podem estar associadas a alterações funcionais, e por outro, que a medição da reserva de fluxo coronário (CFR) por termodiluição é um método de avaliação simples que pode acrescentar informações acerca do atingimento do compartimento microvascular nos doentes que apresentam coronárias angiograficamente normais. Estudos recentemente publicados na literatura mostraram haver uma boa correlação entre a doença microvascular e o prognóstico51,52.
Métodos de diagnóstico não invasivosAo longo dos anos, os métodos de diagnóstico não invasivos, nomeadamente a cintigrafia de perfusão miocárdica, a ecocardiografia de sobrecarga com dobutamina e, mais recentemente, a angiografia por tomografia computorizada e por ressonância magnética cardíaca, têm procurado conquistar um papel na avaliação da DVA. Eles podem ser úteis na deteção da doença em recetores de transplante cardíaco impossibilitados de realizar estudo invasivo e podem ser métodos atrativos para a monitorização da doença em idade pediátrica, na qual se pretende evitar a realização sistemática de métodos invasivos, embora a sua prática não esteja ainda completamente estabelecida8.
Num estudo publicado no ano 2000, foi sugerido que a cintigrafia de perfusão miocárdica pudesse ter um papel no screening anual dos doentes transplantados cardíacos, dado o seu elevado valor preditivo negativo para excluir lesões coronárias graves com necessidade de revascularização53. Mais tarde, Wu et al. confirmaram elevado valor preditivo negativo (96%) da cintigrafia com sobrecarga de dobutamina para exclusão de doença coronária significativa54. E, embora este exame apresente uma baixa sensibilidade para a deteção precoce da DVA, alguns autores mostraram ter valor prognóstico55,56.
A realização de ecocardiograma transtorácico de forma seriada é recomendável de forma a detetar uma possível deterioração progressiva da função ventricular esquerda ou disfunção diastólica tipo restritivo como resultado de isquémia miocárdica silenciosa7.
O primeiro estudo que comparou a ecocardiografia de sobrecarga com dobutamina com a ecografia intravascular incluiu 109 transplantados cardíacos e mostrou que a ecocardiografia de sobrecarga consegue identificar a presença de vasculopatia com uma sensibilidade de 72% e identificar os doentes com pior prognóstico com um valor preditivo elevado, comparável à ecografia intracoronária e angiografia57. Outros autores mostraram também a importância do valor prognóstico desta modalidade de imagem58,59. Mais recentemente, alguns estudos mostraram o valor incremental dos novos parâmetros quantitativos da ecocardiografia, como o Doppler tissular e parâmetros de deformação sistólica, na deteção mais sensível e precoce da doença vascular do transplantado cardíaco60,61. A ecocardiografia mostrou ainda ter potencial na avaliação da microcirculação através da quantificação do fluxo de reserva coronário por ecocardiografia com contraste62–64. A diminuição da reserva de fluxo coronária é um marcador precoce de VA e relaciona-se com a ocorrência de eventos cardiovasculares major65.
Estudos recentes sugeriram que a angiografia por tomografia computorizada com um detetor de 64 cortes pode ser superior à angiografia convencional por cateter ao identificar doença vascular não obstrutiva que pode não ser reconhecida na coronariografia isolada66. Quando comparada com a ecografia intravascular, a angiografia por tomografia computorizada mostrou apresentar uma elevada especificidade (92%) e um aceitável valor preditivo negativo (77%) para a deteção da VA67, podendo vir a ter, no futuro, um papel na monitorização da doença. Embora as frequências cardíacas elevadas que os transplantados cardíacos frequentemente apresentam possa ser uma limitação da qualidade técnica do estudo, Schepis et al. mostraram que a tomografia computorizada com dupla ampola de raios x(dual source) é um exame não invasivo que pode apresentar uma boa acuidade diagnóstica para a VA. Efetuaram a comparação desta modalidade de imagem com a ecografia intravascular em 30 transplantados cardíacos com uma frequência cardíaca média de 80±14 batimentos, e obteve uma especificidade (84%) e um valor preditivo negativo (91%) elevados68.
A angiografia coronária por ressonância magnética cardíaca é uma modalidade de imagem atrativa por ser não invasiva e não requerer o uso de contraste nefrotóxico ou exposição a radiação, mas apresenta ainda uma baixa sensibilidade para a deteção de VA para poder ser usada como método de rastreio69.
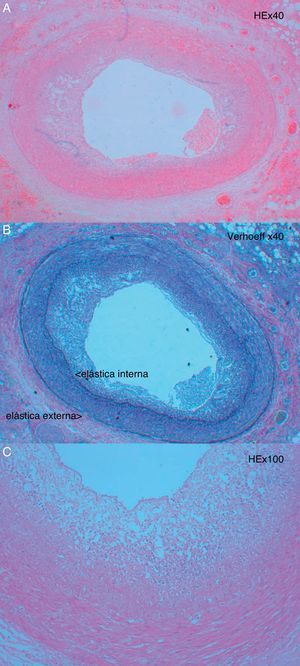
Biopsia endomiocárdicaOs achados da biopsia endomiocárdica têm uma sensibilidade limitada no reconhecimento de vasculopatia, porque as amostras são apenas de pequenas artérias intramiocárdicas e arteríolas onde as lesões típicas de proliferação da íntima (Fig. 3) não são habitualmente visíveis nos primeiros anos pós-transplante28.
BiomarcadoresNo campo da investigação têm surgido inúmeros marcadores baseados na imunologia (p. ex. anticorpos antivimentina70 e anti-HLA32), na genética71 e em proteínas (p. ex. proteína C reativa21, péptido natriurético tipo B72, troponina i73, fator de von Willebrand74) que se procuram afirmar como marcadores de risco de desenvolver a DVA. No entanto, eles ainda não estão incluídos na prática clínica atual como parâmetros para definir a gravidade da doença, porque existem diversos métodos para o seu doseamento que não se encontram estandardizados, com diferentes sensibilidades e especificidades, e não são ainda reprodutíveis entre os diferentes laboratórios7.
Em resumo, os exames de diagnóstico não invasivos, em particular, a angiografia por tomografia computorizada, podem vir a ter um papel na exclusão de DVA significativa, embora com uma menor sensibilidade do que a ecografia intracoronária. O ecocardiograma de sobrecarga com dobutamina pode ser usado para estimar o prognóstico. No futuro, os métodos de imagem não invasivos podem vir a substituir a coronariografia como métodos de screening, reservando a coronariografia com ecografia intravascular para os doentes de alto risco ou para aqueles com resultados equívocos ou positivos nos métodos não invasivos7.
PrevençãoO tratamento da DVA já completamente estabelecida continua muito limitado devido à natureza obliterativa difusa do processo. E, por isso, são necessários esforços na prevenção da doença, que deve ser iniciada o mais precocemente possível, uma vez que o espessamento da íntima arterial pode ocorrer logo no primeiro ano pós-transplante cardíaco75. Antes do transplante, as medidas preventivas incluem prevenção da lesão endotelial, reduzindo o tempo de isquémia, melhorando a preservação e transporte do enxerto. Após o transplante, a prevenção primária deve incluir a otimização da terapêutica imunossupressora, o controlo apertado dos fatores de risco cardiovasculares comuns (hipertensão, dislipidemia, diabetes, obesidade, tabagismo e sedentarismo), assim como estratégias para prevenir a infeção pelo citomegalovírus8.
A hipertensão arterial, a dislipidemia e a diabetes são, na verdade, comorbilidades muito prevalentes na população de transplantados cardíacos, que frequentemente resultam ou são agravadas pela terapêutica imunossupressora em curso1.
A hipertensão tem uma incidência de 76 e 90% a um a cinco anos, respetivamente1. A terapêutica com a ciclosporina, por efeitos diretos e por induzir nefrotoxicidade, é dos principais fatores que aumentam o risco de hipertensão76. O uso de corticoesteroides também pode contribuir para o seu desenvolvimento ou agravamento. Quanto ao tratamento, não existem grandes estudos aleatorizados a mostrar superioridade de uns anti-hipertensores em relação a outros nesta população. Em muitas ocasiões, por ser uma hipertensão de difícil controlo, é necessária a associação entre dois ou mais fármacos anti-hipertensores, nomeadamente, entre os antagonistas do canal de cálcio e os inibidores da enzima de conversão da angiotensina ou antagonistas dos recetores de angiotensina8. A restrição de sal da dieta, a perda de peso e o exercício são adjuvantes da terapêutica que facilitam o controlo da pressão arterial nesta população8,76.
A dislipidemia tem uma incidência de 74% no primeiro ano e 91% ao quinto ano1. Dois estudos aleatorizados que compararam a pravastatina77 ou a sinvastatina78 com placebo nos doentes transplantados cardíacos mostraram o benefício das estatinas na redução da incidência de DVA e na melhoria do prognóstico a longo prazo. Estudos prévios sugerem que o benefício das estatinas pode não estar apenas relacionado com a redução dos níveis de colesterol, mas também com o seu efeito imunossupressor79. E, como tal, o uso de estatinas deve ser considerado em todos os doentes, independentemente do perfil lípidico8.
A diabetes mellitus afeta 39% dos transplantados cardíacos nos primeiros cinco anos1. A terapêutica com inibidores da calcineurina, nomeadamente o tacrolimus80 e glucocorticóides81, contribui para a elevada prevalência de diabetes. Outros fatores de risco incluem a intolerância à glucose oral pré-transplante, história familiar de diabetes e a obesidade82. De acordo com as recomendações atuais, deve optar-se, sempre que possível, por regimes livres de corticoesteroides e com doses mais baixas de inibidores da calcineurina; deve ser realizada uma monitorização periódica da glucose em jejum, testes de tolerância à glucose oral e determinações da HbA1C, sempre que apropriado; e o tratamento da diabetes já estabelecida no doente transplantado cardíaco não deve diferir do da população geral8.
De forma integrada no programa de modificação dos fatores de risco, deve ser incentivada a participação em programas de reabilitação cardíaca que incluam não só um componente de treino aeróbio mas também de resistência8,83,84.
Quando existe infeção, a citomegalovírus, o tratamento antiviral (ganciclovir/valganciclovir) parece reduzir a progressão da doença vascular do aloenxerto12. Por outro lado, o papel da profilaxia da infeção por citomegalovírus na prevenção da vasculopatia não está completamente definido8.
Quanto à terapêutica imunossupressora, na fase imediata pós-transplante, os doentes iniciam habitualmente terapêutica tripla que inclui um inibidor da calcineurina (tacrolimus ou ciclosporina) associado a azatioprina ou a micofenolato de mofetil, em adição a corticoesteroides8. A evidência sugere que há benefício na redução das doses dos inibidores da calcineurina, sempre que possível, uma vez que esta terapêutica está associada a um potencial risco de nefrotoxicidade, a efeitos adversos metabólicos e a disfunção endotelial, podendo contribuir para a progressão da vasculopatia no transplantado cardíaco85.
Outros fármacos têm sido sugeridos como protetores da progressão da VA, nomeadamente o imunossupressor micofenolato mofetil usado em combinação com um inibidor da calcineurina, que, quando comparado com a azatioprina, mostrou uma redução do espessamento da íntima no primeiro ano pós-transplante cardíaco, que se traduziu numa diminuição da mortalidade e do retransplante aos 36 meses86.
O uso do everolimus87 e do sirolimus88, com propriedades antiproliferativas, mostraram reduzir a gravidade e a incidência de VA, aos 12 e 24 meses respetivamente, quando comparados com a azatioprina. E, por isso, as recomendações atuais consideram que, na DVA já estabelecida, pode ser considerada a substituição da azatioprina ou do micofenolato mofetil por um destes dois fármacos8. A maior parte dos centros não utiliza estes fármacos na fase aguda pós-transplante porque, pelas suas propriedades antiproliferativas, podem atrasar a cicatrização da ferida operatória.
O manejo adequado da terapêutica imunossupressora pode ser essencial na fase precoce de desenvolvimento da DVA, porque alguns estudos sugerem poder parar a progressão ou mesmo provocar uma regressão da vasculopatia88,89.
TratamentoAssim que a DVA se encontra completamente estabelecida, a revascularização por intervenção percutânea ou a cirurgia são opções viáveis; no entanto, são consideradas terapêuticas paliativas, porque não alteram a progressão da doença, a necessidade de reintervenção ou a sobrevida global90–92. A angioplastia coronária é normalmente o tratamento de escolha para estenoses graves focais. Pode ser realizada com uma elevada taxa de sucesso e um número reduzido de complicações, mas com o risco de reestenose superior à da população geral93. Sempre que possível, é recomendado o uso de stents revestidos por fármaco, porque reduzem a frequência de reestenose quando comparados com stents metálicos, embora a sobrevida seja semelhante nos 2 tipos de stents93–96.
A única terapêutica definitiva continua a ser a retransplantação que pode ser considerada em doentes com VA grave e sem contraindicações para um novo transplante97. O retransplante cardíaco encontra-se associado a uma sobrevida global inferior à do primeiro transplante. No entanto, quando este é efetuado após cinco anos do primeiro transplante, a sobrevida a um ano é satisfatória e comparável à do transplante primário1. A retransplantação cardíaca no contexto específico da DVA também parece estar associada a melhor sobrevida quando comparada com outras causas de retransplante98.
ConclusãoA DVA é de causa multifatorial e constitui a principal limitação da sobrevida a longo prazo pós transplantação cardíaca. O seu diagnóstico precoce é difícil, mas reveste-se de grande importância, porque permite tratar a doença num estadio inicial de forma a atrasar a sua progressão e melhorar o prognóstico. A angiografia coronária permanece o método de diagnóstico recomendado para a deteção da doença e ganha sensibilidade se for realizada conjuntamente com a ecografia intravascular. Novas técnicas de diagnóstico não invasivas podem vir a ter relevância clínica no futuro. De realçar que a abordagem do doente transplantado passa pela melhor concertação das formas de tratamento nos diferentes centros. Porque só é possível melhorar a sobrevida global do doente transplantado cardíaco se, em conjunto, conseguirmos detetar mais precocemente, prevenir melhor e tratar mais ativamente a DVA.
Conflito de interessesOs autores declaram não haver conflito de interesses.
Os autores agradecem à Dr.a Sância Ramos do laboratório de patologia do Hospital de Santa Cruz (C.H.L.O.) pela sua colaboração no âmbito da patologia da DVA.