O choque cardiogénico é caracterizado por uma diminuição da contratilidade miocárdica, apresentando uma mortalidade elevada. A instituição de terapêutica inotrópica e vasopressora é recomendada e utilizada há vários anos no tratamento de doentes em choque, mas continua a ser um tema controverso. Apesar do efeito benéfico na contratilidade miocárdica, os efeitos secundários dos inotrópicos (arritmias e aumento do consumo miocárdico de oxigénio) podem‐se associar a um aumento da mortalidade.
A farmacodinâmica dos diferentes agentes inotrópicos sugere benefícios em determinadas situações, no entanto, estas diferenças não foram traduzidas em redução da mortalidade na maioria dos estudos, dificultando a criação de recomendações.
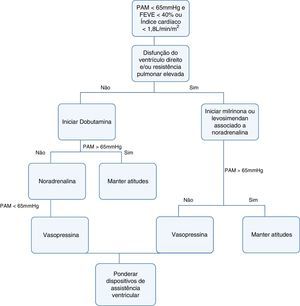
Esta revisão pretende integrar os dados dos diferentes estudos, com fármacos inotrópicos e vasopressores, em doentes com choque cardiogénico, sendo proposto um diagrama para o tratamento farmacológico de doentes em choque cardiogénico, de acordo com o perfil hemodinâmico do doente.
Cardiogenic shock is characterized by a decrease in myocardial contractility, and presents a high mortality rate. Inotropic and vasopressor agents have been recommended and used for several years in the treatment of patients in shock, but they remain controversial. Despite its beneficial effect on myocardial contractility, the side effects of inotropic therapy (arrhythmias and increased myocardial oxygen consumption) may be associated with increased mortality.
The pharmacodynamics of different inotropic agents suggest benefits in specific situations, but these differences have not been reflected in reduced mortality in most studies, making it difficult to formulate recommendations.
This review integrates data from different studies on the use of inotropes and vasopressors in patients with cardiogenic shock, proposing a therapeutic scheme for the pharmacological treatment of patients in cardiogenic shock according to the patient's hemodynamic profile.
O choque cardiogénico é um estado de hipoperfusão tecidular, condicionado por uma diminuição do débito cardíaco, estando, apesar de um volume intravascular adequado, habitualmente presentes os seguintes parâmetros hemodinâmicos: pressão arterial sistólica inferior a 90mmHg, por mais de 30min (sem suporte inotrópico ou vasopressor), índice cardíaco baixo (inferior a 1,8L/min/m2 sem assistência ou inferior a 2,2L/min/m2 com assistência) e pressões de enchimento do ventrículo esquerdo aumentadas (pressão capilar pulmonar>18mmHg)1,2 (Figura 1).
A causa mais frequente de choque cardiogénico é o enfarte agudo do miocárdio (EAM) que representa quase metade dos casos, podendo ocorrer em 5‐15% destes doentes, nas diferentes séries3. Desde o SHOCK trial que a terapêutica por angioplastia é a preferida no tratamento dos doentes com EAM em choque cardiogénico4. Avanços na terapêutica, nomeadamente no acesso à revascularização, têm diminuído a mortalidade por EAM e a incidência de choque cardiogénico, contudo a sua ocorrência é preditora de uma taxa de mortalidade elevada3,5,6.
Na literatura é possível encontrar descrições da utilização de fármacos inotrópicos e vasopressores no tratamento do choque cardiogénico desde a década de 507,8, no entanto, são poucos os estudos clínicos que envolvam este tipo de doentes, pelo que a escolha entre os fármacos a utilizar permanece controversa. Os autores efetuaram uma compilação dos trabalhos encontrados na literatura com fármacos inotrópicos e vasopressores, procurando identificar as indicações para a utilização de cada fármaco.
InotrópicosOs fármacos inotrópicos aumentam a contratilidade miocárdica, com consequente aumento do débito cardíaco. Muitos destes fármacos aumentam também a frequência cardíaca com o consequente aumento do consumo de O2 pelo miocárdio, o que pode ser prejudicial em alguns doentes. Para além das propriedades inotrópicas, possuem ainda propriedades vasoconstritoras ou vasodilatadoras.
Atualmente, estes fármacos são maioritariamente utilizados para estabilizar doentes com insuficiência cardíaca aguda. Enumeram‐se, em seguida, os principais fármacos inotrópicos e respetivas características (Tabela 1).
Fármacos utilizados no choque cardiogénico
| Classe | Mecanismo de ação | Semivida | Dose infusão | |
|---|---|---|---|---|
| Adrenalina | Catecolaminas | Agonista α e β adrenérgico | 2min | 0,01‐1,0ug/kg/min |
| Dobutamina | Catecolaminas | Agonista β adrenérgico | 2‐3min | 2‐20ug/kg/min |
| Dopamina | Catecolaminas | Agonista α e β adrenérgico e dopaminérgico | 2min | 1‐20ug/kg/min |
| Milrinona | Inibidores da fosfodiesterase | Aumento de AMPc por inibição de PDE‐III | 2h | 0,375‐0,750ug/kg/min |
| Levosimendan | Sensibilizador do cálcio | Aumento da sensibilidade da troponina C ao Ca2+ intracelular | 1h (metabolito até 80h) | 0,1‐0,4ug/kg/min |
| Noradrenalina | Catecolaminas | Agonista α adrenérgico | 2‐2,5min | 0,2‐1ug/kg/min |
| Vasopressina | Vasopressor | Agonista recetores da vasopressina (V1 e V2) | 10‐20min | 0,6‐6UI/h |
A adrenalina é um fármaco simpaticomimético com afinidade para se ligar aos recetoresαeβadrenérgicos. Este fármaco aumenta a pressão arterial média por aumentar o débito cardíaco e o tónus vascular periférico9, sendo por isso considerado o seu uso nos indivíduos em choque. O seu efeito foi testado em ensaios clínicos com doentes em choque séptico, constatando‐se uma eficácia e mortalidade semelhantes à da norepinefrina10,11.
Levy et al.12 realizaram um ensaio com 30 doentes em choque cardiogénico, não causado por uma síndrome coronária aguda, comparando a adrenalina com a combinação noradrenalina e dobutamina. A eficácia, em termos de valores de pressão arterial, consumo de oxigénio e melhoria da função renal, foi semelhante e a mortalidade sobreponível. No mesmo estudo, foi ainda observado que os doentes submetidos ao tratamento com adrenalina apresentavam um aumento transitório dos valores de ácido lático e da glicemia, e uma frequência cardíaca mais elevada (três doentes apresentaram taquiarritmias no grupo da adrenalina e nenhum no outro grupo). O grupo de Morici et al.13 sugere que este agente é importante na estabilização hemodinâmica dos doentes com choque cardiogénico, apresentando um melhor «perfil» do que os restantes fármacos habitualmente utilizados, pois para aumentos semelhantes da pressão arterial, o balanço entre o efeito inotrópico e vasoconstritor da adrenalina permitiu não só um aumento da frequência cardíaca menos marcado do que a dopamina, mas também uma vasoconstrição menos intensa do que com noradrenalina e, assim, um menor efeito na «pós‐carga».
DobutaminaA dobutamina é um fármaco que atua no miocárdio por estimulação dos recetores β1 adrenérgicos aumentando a sua contratilidade, e ao nível do músculo liso nos recetores β2 adrenérgicos causando vasodilatação14. Foi rapidamente aceite para o tratamento do choque cardiogénico, dado o seu potencial em aumentar o débito cardíaco e diminuir as pressões de enchimento ventricular esquerdo15,16.
Francis et al.17 compararam os efeitos hemodinâmicos da dobutamina com os efeitos da dopamina e descrevem um menor aumento da frequência cardíaca, menor incidência de arritmias, menos vasoconstrição periférica e uma diminuição mais consistente da pressão de enchimento ventricular esquerda, para uma subida semelhante do débito cardíaco.
Richard et al.18 também concluíram que a combinação dopamina e dobutamina consegue um aumento do débito cardíaco semelhante à infusão isolada de dopamina, mas com um menor consumo de O2.
Em doentes a aguardar transplante cardíaco confrontou‐se a eficácia da dobutamina versus milrinona, com alguns autores a apontarem resultados semelhantes19 e outros a favorecer a milrinona, tanto na mortalidade20 como na menor necessidade de dispositivos de assistência ventricular na ponte para transplante21.
Numa meta‐análise de 2012, Tacon et al.22 analisaram 14 estudos, num total de 673 doentes com insuficiência cardíaca avançada, em que foi comparada a dobutamina com placebo ou terapêutica convencional, registando‐se um aumento da mortalidade nos doentes tratados com dobutamina, embora sem significado estatístico.
DopaminaA dopamina é um precursor natural da noradrenalina e da adrenalina, com efeitos dose dependentes. Em doses baixas (1‐2ug/kg/min) a dopamina tem efeitos vasodilatadores ao se ligar a recetores dopaminérgicos. Em doses mais elevadas (5‐10ug/kg/min) tem efeitos agonista β1 adrenérgico e consequentemente efeito inotrópico, tendo em doses ainda mais elevadas (superiores a 10ug/kg/min) um efeito agonista α adrenérgico, causando vasoconstrição e subsequente aumento da pressão arterial14,23.
Foi durante muito tempo considerado que a dopamina apresentava um efeito benéfico a nível da função renal, efeito que não foi demonstrado em dois ensaios24,25, pressupondo que não deverá ser utilizada com esse propósito.
Apesar de longamente utilizado, este fármaco tem vindo a ser cada vez menos preponderante no choque cardiogénico pois, numa subanálise do ensaio SOAPII26, os doentes com choque cardiogénico que se encontravam sob este fármaco apresentaram maior número de eventos arrítmicos e mortalidade, quando comparados com aqueles tratados com noradrenalina. Uma possível explicação para esta diferença entre a noradrenalina e a dopamina no choque é a diminuída capacidade de resposta a agentes indiretos, como é o caso da dopamina, por défice na libertação de neurotransmissores nos doentes em choque27. Apesar destes dados, em 2009, um estudo português de Póvoa et al.28 demonstrou que em doentes com choque séptico a dopamina se associava a menor mortalidade do que a noradrenalina.
MilrinonaA milrinona é um fármaco inibidor da fosfodiesterase (PDE). Ao inibir a PDE‐3 (enzima que degrada o monofosfato de adenosina cíclico [AMPc]), aumenta os níveis de AMPc, facilitando a entrada de cálcio nos miócitos e aumentando a contratilidade miocárdica. Ao nível do músculo liso vascular periférico, esta menor degradação do AMPc aumenta a remoção do cálcio intracelular, condicionando relaxamento e vasodilatação29. Este agente é descrito como sendo inotrópico positivo, vasodilatador periférico e com propriedades lusitrópicas.
O facto de não aumentar a frequência cardíaca como os fármacos catecolaminérgicos, pressupôs sempre a vantagem teórica de que não teria impacto negativo no consumo de oxigénio ao nível miocárdico30.
Os primeiros estudos comparativos da milrinona com a dobutamina31 demonstraram que estes fármacos tinham igual eficácia no aumento do índice cardíaco, mas com uma redução da pressão de enchimento ventricular esquerdo, ventricular direito e da pressão arterial mais marcadas com a milrinona.
Foi demonstrado que a milrinona pode permitir a redução da dose de catecolaminas em doentes com choque cardiogénico dependente das mesmas, muitas vezes de difícil desmame. Num estudo de Siostrzonek et al.32 que envolveu 20 doentes, a utilização da milrinona permitiu inclusivamente a remoção das catecolaminas e alta mais precoce da unidade de cuidados intensivos. Contudo, em alguns doentes foi necessário aumentar o suporte vasopressor.
No maior ensaio até à data que envolveu a milrinona, o OPTIME‐CHF33, comparou‐se a sua eficácia versus placebo em doentes internados por descompensação de insuficiência cardíaca crónica (foram, no entanto, excluídos os doentes em choque). A milrinona não demonstrou superioridade no tempo de hospitalização ou na mortalidade a 60 dias, tendo aumentado o número de casos de hipotensão e de taquiarritmias auriculares.
No registo ADHERE34, publicado em 2005, que incluiu doentes com insuficiência cardíaca aguda, os agentes inotrópicos registaram maior mortalidade do que os vasodilatadores, no entanto, neste registo apenas 2,5% dos doentes apresentavam pressão arterial sistólica inferior a 90mmHg, pelo que estes resultados não são extrapoláveis para os doentes em choque. Os agentes inotrópicos utilizados foram a dobutamina e a milrinona, tendo os doentes sob dobutamina apresentado maior mortalidade do que os doentes sob milrinona.
Em doentes com insuficiência cardíaca avançada com necessidade prolongada de inotrópicos, a milrinona oral em ambulatório foi associada a um aumento da mortalidade quando comparada com placebo35. Verificou‐se, no entanto, boa tolerância quando associado a betabloqueantes36. Já mais recentemente foi comparada a sua eficácia em administração endovenosa contínua com a dobutamina, ocorrendo uma mortalidade semelhante em ambos os grupos37.
A importância da milrinona em indivíduos com diminuição da função do ventrículo direito e aumento da resistência vascular pulmonar foi descrita por Pamboukian et al.38, tendo este resultado sido demonstrado também por Eiran et al.39, num ensaio onde se comparou a milrinona com dobutamina, tendo a milrinona apresentado melhoria da função sistólica ventricular direita e redução da pressão na artéria pulmonar.
LevosimendanO levosimendan é o mais recente inotrópico disponível para o tratamento de insuficiência cardíaca aguda. Este fármaco aumenta a sensibilidade da troponina C do aparelho contrátil ao cálcio intracelular, apresentando propriedades inotrópicas e lusitrópicas40–42. Tem ainda uma ação sobre os canais de potássio dependentes do ATP, promovendo relaxamento do músculo liso vascular e consequentemente vasodilatação coronária e periférica34. O efeito do levosimendan é dose‐dependente, com impacto demonstrado no perfil hemodinâmico de doentes com insuficiência cardíaca43, podendo o efeito do seu metabolito ativo durar cinco dias após a suspensão do fármaco44.
Em doentes com insuficiência cardíaca aguda, alguns ensaios45–50 demonstraram que este fármaco não tem impacto na mortalidade quando comparado com placebo, com resultados controversos quando comparado com outros fármacos inotrópicos. No estudo REVIVE II45 o grupo tratado com levosimendan teve um benefício precoce ao nível da sintomatologia dos doentes e redução do valor BNP quando adicionado levosimendan ao tratamento versus placebo, mas com tendência para um aumento da mortalidade. No estudo LIDO46, o levosimendan foi comparado com a dobutamina, em doentes com insuficiência cardíaca descompensada e necessidade de terapêutica inotrópica. Aos 180 dias, o levosimendan apresentou menor mortalidade e maior número de dias até novo internamento. O estudo LEAF47 avaliou a eficácia do levosimendan versus placebo em doentes submetidos a angioplastia primária após EAM complicado de insuficiência cardíaca, observando‐se uma melhoria da contratilidade miocárdica, mas sem benefício em termos de mortalidade. Neste estudo apenas nove doentes apresentaram choque cardiogénico, não tendo havido diferenças significativas entre os grupos. Também em Portugal foi realizado um estudo com levosimendan, o estudo PORTLAND48, onde foram incluídos 129 doentes com insuficiência cardíaca aguda e função do ventrículo esquerdo deprimida, mas excluídos os doentes em choque cardiogénico, neste observou‐se que este é um fármaco seguro, com aparente melhoria sintomática dos doentes e diminuição de internamentos no follow‐up a seis meses. No entanto, neste estudo o levosimendan não foi comparado com outras terapêuticas, mas sim com os dados dos internamentos por insuficiência cardíaca existentes no país.
Samimi‐Fard et al.49 compararam os resultados aos 12 meses de follow‐up entre o levosimendan e a dobutamina, em 22 doentes com choque cardiogénico após EAM, submetidos a angioplastia coronária primária, não sendo evidenciado diferenças significativas. Fuhrmann et al.50 compararam o levosimendan com a enoximona em 32 doentes com choque cardiogénico, descrevendo uma diminuição da mortalidade nos doentes tratados com levosimendan aos 30 dias.
Para além dos efeitos na função ventricular esquerda, foi também demonstrado51, num pequeno estudo com 25 doentes, que o levosimendan pode melhorar a função do ventrículo direito e reduzir a resistência vascular pulmonar, podendo ter um papel na disfunção do ventrículo direito em doentes em choque cardiogénico após EAM.
VasopressoresOs fármacos vasopressores são considerados o tratamento a instituir a doentes em choque, com resistências vasculares sistémicas baixas, que não respondem à administração de fluídos. No choque cardiogénico reconhece‐se que pode persistir um estado pró‐inflamatório sistémico que condiciona vasoplegia52, o que conduz à necessidade de utilização de agentes vasopressores com o objetivo de manter a pressão arterial dos doentes. Os agentes inotrópicos com propriedades vasoconstritoras como a dopamina e a adrenalina podem ser usados com esta finalidade, mas o fármaco que tem demonstrado maior impacto na mortalidade de doentes em choque é a noradrenalina26. Descrevem‐se a seguir os dois fármacos com propriedades vasoconstritoras mais utilizados atualmente (Tabela 1).
NoradrenalinaA noradrenalina é uma catecolamina com efeito α adrenérgico, sendo utilizado como um agente vasopressor com o objetivo de aumentar a pressão arterial em doentes em choque. Em 19537, aparece a descrição do primeiro caso clínico de um doente em choque cardiogénico após um EAM tratado com noradrenalina. Apesar do falecimento do doente (choque cardiogénico complicado por sépsis), é descrita uma melhoria do perfil hemodinâmico após o início da infusão deste fármaco.
Complicações da infusão de noradrenalina como a diminuição do fluxo sanguíneo renal e esplâncnico, em especial em doentes com necessidade de volume, são amplamente conhecidas53.
As guidelines da Sociedade Europeia de Cardiologia de EAM com supradesnivelamento de ST54 são confusas no que se refere à terapêutica de doentes em choque cardiogénico, pois no texto é referido que a noradrenalina será o fármaco a eleger em doentes em choque cardiogénico com pressão arterial baixa; no entanto, aparece a dopamina com classe de recomendação IIa/C e a noradrenalina como IIb/B.
Como já referido, no estudo SOAPII26, a noradrenalina exibiu menor mortalidade do que a dopamina em doentes em choque cardiogénico. É considerado, assim, o fármaco de eleição em doentes em choque cardiogénico, podendo ser associado a um agente inotrópico.
VasopressinaA vasopressina é um agente com afinidade para recetores próprios. Ao se ligar aos recetores V1, causa vasoconstrição pela contração do músculo liso vascular23,55, e pela ligação aos recetores V2 promove a reabsorção de água ao nível do sistema excretor renal55. Em doentes com choque séptico provou ser uma terapêutica eficaz e segura, em associação à noradrenalina23, permitindo reduzir as doses de outros vasopressores55.
Na paragem cardiorrespiratória, verificou‐se que a vasopressina tem uma eficácia semelhante à adrenalina na reanimação de doentes em fibrilhação ventricular ou atividade elétrica sem pulso e uma eficácia superior na presença de assistolia56.
Num pequeno estudo57 retrospetivo de doentes com choque cardiogénico foi descrito que, naqueles sob dopamina, a adição de vasopressina não é inferior em relação à noradrenalina, quando avaliado o aumento da pressão arterial média e os restantes parâmetros hemodinâmicos, sem haver contudo um benefício na mortalidade.
Constatou‐se também boa resposta à administração de vasopressina em doentes hipotensos após implantação de dispositivos de assistência ventricular esquerda, permitindo uma diminuição da necessidade de noradrenalina58.
No entanto, até à data, não existem ensaios clínicos randomizados em doentes com choque cardiogénico tratados com vasopressina.
DiscussãoOs vários estudos sobre esta temática tornam bem evidentes as muitas incertezas que existem na utilização destes fármacos no choque cardiogénico (Tabela 2).
Estudos com fármacos inotrópicos e vasopressores
| Nome do estudo, autores, ano | Objetivos | Tipo estudo | n | População | Endpoints | Resultados | |
|---|---|---|---|---|---|---|---|
| Critérios inclusão | Critérios exclusão | ||||||
| Levy et al. 201112 | Comparar os efeitos hemodinâmicos, metabolismo de lactatos e impacto na perfusão sistémica da adrenalina e combinação dobutamina‐noradrenalina | Randomizado | 30 | Índice cardíaco <2,2L/min/m2 PAM<60mmHg Sinais de hipoperfusão sistémica Ausência de hipovolemia | Síndrome coronária aguda | Frequência cardíaca Pressão arterial PCO2 mucosa gástrica Níveis lactatos | Efeitos hemodinâmicos semelhantes da associação noradrenalina‐dobutamina e adrenalina. A adrenalina provocou aumento transitório de lactatos, da frequência cardíaca e, diminuiu a perfusão da mucosa gástrica |
| Myburgh et al. 200810 | Detetar quais as diferenças entre a adrenalina e a noradrenalina no alcance de PAM em doentes internados em cuidados intensivos | Randomizado | 280 | Doentes internados em cuidados intensivos candidatos a terapêutica com noradrenalina ou adrenalina | Pós‐paragem cardiorrespiratória Anafilaxia a um dos fármacos Feocromocitoma Hipoadrenalismo Terapêutica com inibidores da MAO (monoamina oxidase) | Tempo até alcançar PAM. Mortalidade aos 28 e aos 90 dias | Não foram encontradas diferenças em nenhum dos endpoints |
| Annane et al. 200711 | Eficácia e segurança da combinação noradrenalina‐dobutamina versus adrenalina no choque séptico | Randomizado | 330 | Doentes com diagnóstico de choque séptico | Gravidez Cardiomiopatia obstrutiva Síndrome coronário agudo Outros tipos de choque | Mortalidade aos 28 dias | Mortalidade semelhante nos dois grupos |
| Francis et al. 198217 | Comparar os efeitos hemodinâmicos da dobutamina com a dopamina no choque cardiogénico | Randomizado | 13 | Doentes com diagnóstico de choque cardiogénico | Outros tipos de choque | Frequência cardíaca Arritmias Perfusão periférica Pressão enchimento VE Débito cardíaco | Dobutamina apresentou maior aumento do débito e do índice cardíaco que a dopamina. |
| Richard et al. 198318 | Determinar a eficácia da combinação dobutamina‐dopamina no choque cardiogénico | Randomizado | 8 | Doentes em choque cardiogénico sob ventilação invasiva | N/A | PAM PCP Índice cardíaco Frequência cardíaca | A combinação dobutamina‐dopamina permitiu um aumento da PAM e manteve a PECP dentro de limites normais. |
| Aranda et al. 200319 | Compara «outcomes» clínicos associados com o uso de dobutamina ou milrinona em doentes hospitalizados à espera de transplante cardíaco | Randomizado | 36 | Doentes em lista de transplante cardíaco dependentes de terapêutica inotrópica | Intolerância a dobutamina ou milrinona Instabilidade hemodinâmica com necessidade de dispositivos de suporte mecânico | Perfil hemodinâmico Arritmias ventriculares Necessidade de terapêutica vasodilatadora ou inotrópica adicional | Não foram encontradas diferenças entre os dois fármacos |
| Mehra et al. 199721 | Avaliar a segurança da milrinona i.v. durante mais de 72h e avaliar a utilidade deste fármaco como ponte para transplante cardíaco na IC avançada | Observacional | 71 | Dependência de terapêutica inotrópica Estabilidade hemodinâmica>72h Utilização de milrinona>72h | N/A | Necessidade de suporte circulatório mecânico Efeitos adversos cardíacos | A milrinona demonstrou ser um fármaco seguro por períodos>72hDiminuiu a necessidade de terapêutica de suporte circulatório |
| SOAP II De Backeret al. 201026 | Avaliar se a escolha de noradrenalina versus dopamina como agente vasopressor de 1.ª linha diminui a taxa da mortalidade nos doentes em choque | Randomizado | 1679 | PAM<70mmHg após 1000ml de cristaloides ou 500ml de coloides e sinais de hipoperfusão tecidular | <18 anos Terapêutica vasopressora prévia por mais de 4h Arritmias não controladas Taquicardia ventricular Morte cerebral | Taxa mortalidade aos 28 dias, aos seis e 12 meses. Eventos adversos | Taxa mortalidade semelhante entre os dois fármacos. Dopamina associou‐se a mais arritmias. Análise subgrupo choque cardiogénico dopamina teve mortalidade superior à da noradrenalina |
| SACiUCI Póvoa et al. 200928 | Avaliar qual o impacto da escolha da terapêutica vasopressora na mortalidade do choque séptico | Observacional | 458 | Todos os doentes admitidos por choque séptico | N/A | Mortalidade hospitalar e aos 28 dias | Noradrenalina apresentou maior mortalidade hospitalar e aos 28 dias que a dopamina |
| Colucci et al. 198631 | Avaliar os efeitos hemodinâmicos da milrinona e dobutamina na insuficiência cardíaca avançada | Prospetivo Não randomizado | 15 | Doentes com IC NYHA III‐IV | N/A | Índice cardíaco Pressões enchimento VE e VD Resistência vascular periférica | Igual aumento do índice cardíaco Milrinona teve maior descida dos valores das pressões de enchimento do VE e VD e das resistências vasculares periféricas |
| OPTIME‐CHF Cuffe et al. 200233 | Avaliar o impacto da utilização de milrinona ou placebo em adição à terapêutica «standard» em doentes hospitalizados por insuficiência cardíaca | Randomizado | 949 | Hospitalização por IC NYHA II‐IV FEVE<40% | Necessidade de inotrópico i.v. Síndrome coronária aguda FA mal controlada Taquicardia ventricular/fibrilhação ventricular | Dias de hospitalização nos 60 dias após randomização. Eventos adversos | Sem diferenças nos dias de hospitalização. Milrinona apresentou mais efeitos adversos |
| ADHERE Adams et al. 200534 | Compara a mortalidade em doentes com IC aguda medicados com um de quatro agentes vasoativos (nitroglicerina, nesiritide, milrinona e dobutamina) | Registo | 65180 | Doentes admitidos em hospitais de agudos cardíacos e com o diagnóstico de IC | Diagnóstico principal não ser IC | Mortalidade hospitalar Tempo de estadia hospitalar | Maior mortalidade e tempo de estadia hospitalar nos doentes sob inotrópicos do que nos sob vasodilatadores (milrinona 12,3%, mobutamina 13,9%, nitroglicerina 4,7%, nesiritide 7,1%) |
| PROMISE Packer et al. 199135 | Determinar o efeito da milrinona oral (versus placebo) na mortalidade de doentes com IC avançada que se mantêm sintomáticos apesar da terapêutica convencional | Randomizado | 1008 | NYHA III‐IV FEVE<35% Sob digoxina, diuréticos e IECA | Doença valvular obstrutiva Miocardite aguda Cardiomiopatia hipertrófica Amiloidose cardíaca Patologia tiroideia não controlada | Mortalidade cardiovascular hospitalar | Aumento da mortalidade nos doentes sob milrinona |
| Gorodeski et al. 200937 | Investigar o impacto na mortalidade entre a escolha de milrinona ou dobutamina em doentes com IC dependentes de inotrópicos | Caso‐controlo | 112 | IC dependente de inotrópicos | N/A | Sobrevida | Sem diferenças na mortalidade entre dobutamina e milrinona |
| Pamboukian et al. 199938 | Determinar os efeitos da milrinona na resistência vascular pulmonar | Observacional Retrospetivo | 19 | Doentes candidatos a transplante cardíaco com hipertensão pulmonar | N/A | Resistência vascular pulmonar Débito cardíaco Pressão art. Pulmonar PECP | A milrinona diminui a resistência vascular pulmonar, a pressão da art. pulmonar e a PECP com aumento do débito cardíaco |
| REVIVE II Packer et al. 201345 | Avaliar a eficácia e segurança do levosimendan (versus placebo) em doentes com IC aguda | Randomizado | 700 | Hospitalização por IC aguda FEVE<35% | Entubação orotraqueal PAS≤90mmHg FC>120bpm Angina nas 6h prévias CVE nas 4h prévias Obstrução valvular AVC/AIT Insuficiência hepática Insuficiência renal (Cr.>5mg/dl) DPOC severa Anemia Hb<10g/dl Infecção ativa K+<3,5/>5,4mEq/L História de torsades de pointes | Morte Sintomas Agravamento IC BNP | Mortalidade aos 14 dias semelhante Grupo do Levosimendan: ‐ alta mais precoce ‐ diminuição do BNP aos 5 dias mais marcada Niveis de BNP aos 31 dias sobreponíveis |
| LIDO Follath et al. 200246 | Comparar os efeitos do levosimendan com os da dobutamina na performance hemodinâmica e «outcome» clínico em doentes com baixo débito cardíaco | Randomizado | 203 | Hospitalização por IC com baixo débito cardíaco e necesside de inotrópicos Deterioração de IC crónica apesar de terapêutica óptima IC severa após cirurgia cardíaca IC aguda com FEVE<35% Índice cardíaco<2,5L/min/m2 PECP>15mmHg | Idade<21 anos Idade fértil se mulher Cardiomiopatia hipertrófica ou restritiva Doença valvular estenótica Dor torácica na randomização TV/FV nas últimas duas semanas FC>120bpm PAS<85mmHg Insuficiência renal severa Insuficiência hepática Tamponamento cardíaco Choque séptico SDRA | Melhoria hemodinâmica às 24h: ‐ aumento de 30% ou mais no débito cardíaco ‐ diminuição da PECP de 25% Mortalidade Número de dias até novo internamento | Levosimendan conseguiu melhoria hemodinâmica superior à dobutamin. Menor mortalidade aos 180 dias com o levosimendan (26 versus 38%) |
| LEAF Husebye et al. 201247 | Avaliar a eficácia e segurança do levosimendan (versus placebo) em doentes com EAM com SST, submetidos a angioplastia 1.°, complicada por IC sintomática | Prospetivo Não randomizado | 61 | EAM com SST após angioplastia 1.° com: ‐ abertura de vaso culprit ‐ alterações em pelo menos três segmentos do VE ‐ insuficiência cardíaca com um dos seguintes: Edema agudo de pulmão, Necessidade de CPAP ou ventilação invasiva, necessidade de diuréticos ev por congestão, oligúria persistente ‐ choque: PAS<90mmHg, hipoperfusão sistémica | <20 anos FC>120bpm Choque séptico SDRA Cr.>450umol/L Insuficiência hepática severa Obstrução saída do VE significativa Alergia a um dos fármacos Anemia Gravidez | Alteração do índice de motilidade do VE Alteração do NT‐Pro BNP Tamanho enfarte aos 42 dias Tempo até MACE (morte, EAM não fatal, revascularização, reospitalização por IC) | Levosimendan melhora o índice de motilidade do VE pós EAM. MACE igual nos dois grupos |
| PORTLAND Silva‐Cardoso et al. 200948 | Avaliar a eficácia clínica e segurança do levosimendan no tratamento da IC aguda sistólica na prática clínica diária | Prospetivo Não randomizado | 129 | NYHA III‐IV FEVE<40% Descompensação de IC com necessidade de inotrópicos | Choque Taquiarritmia não controlada Angina em repouso ou pós EAM História de torsades de pointes Obstrução mecânica do enchimento ou da ejeção do VE Insuficiência renal severa (Cr.>3mg/dl) Insuficiência hepática severa Anemia (Hb<9g/dl) Gravidez Alergia ao levosimendan | Proporção de doentes nos quais o levosimendan é seguro e eficaz às 24h Proporção de doentes nos quais o levosimendan é seguro e eficaz aos cinco dias | Levosimendan foi eficaz e seguro com aparente melhoria sintomática. Redução de internamentos aos seis meses nos doentes tratados com levosimendan |
| Samimi‐Fard et al. 200749 | Determinar o efeito na sobrevida a longo prazo do levosimendan comparado com dobutamina em doentes com EAM com supraST e angioplastia primária que desenvolvem choque cardiogénico | Randomizado | 22 | EAM com SST submetido a angioplastia 1.° e choque cardiogénico | Enfarte com disfunção do ventrículo direito Taquicardia ventricular Regurgitação mitral significativa | Mortalidade aos 12 meses | Mortalidade aos 12 meses igual entre os dois grupos |
| Fuhrmann et al. 200850 | Investigar os efeitos do levosimendan e da enoximona no choque cardiogénico refratário que complica o EAM | Randomizado | 32 | Choque cardiogénico refratário após revascularização, balão intra‐aórtico, fluidoterapia e inotrópicos. Índice cardíaco<2,5L/min/m2 PECP≥8mmHg Sinais de hipoperfusão | Complicação mecânica do EAM Doença valvular estenótica Taquicardia ventricular Hemorragia major Insuficiência hepática severa Sépsis Choque cardiogénico>24h | Mortalidade aos 30 dias | Levosimendan apresentou menor mortalidade que enoximona (31,3 versus 62,5%) |
| Russ et al. 200951 | Comparar os efeitos do levosimendan na função do VE e VD em doentes com choque cardiogénico após EAM | Observacional | 25 | EAM e choque cardiogénico | N/A | Índice cardíaco do VE e VD Resistência vascular pulmonar | Levosimendan melhora os parâmetros hemodinâmicos na função do VE e do VD |
| Jolly et al. 200557 | Examinar os efeitos da vasopressina no índice cardíaco e débito urinário em doentes com choque após EAM | Retrospetivo | 30 | Choque nos 1.°s cinco dias após EAM. Terapêutica com dopamina que necessitou de noradrenalina ou vasopressina Doentes com cateter arterial pulmonar | N/A | PAM Índice cardíaco PECP | Vasopressina teve aumento da PAM, sem efeitos no índice cardíaco ou na PECP |
AIT: acidente isquémico transitório; AVC: acidente vascular cerebral; CVE: cardioversão elétrica; DPOC: doença pulmonar obstrutiva crónica; EAM: enfarte agudo do miocárdio; EAM com SST: enfarte agudo do miocárdio com supradesnivelamento do segmento ST; FEVE: fração de ejeção do ventrículo esquerdo; FC: frequência cardíaca; IC: insuficiência cardíaca; N/A: não apresentados; PAM: pressão arterial média; PAS: pressão arterial sistólica; PECP: pressão de encravamento capilar pulmonar; VD: ventrículo direito; VE: ventrículo esquerdo.
Avaliando os resultados descritos, nenhum agente inotrópico foi sugerido como superior ao placebo, tendo, no entanto, quando comparados com outros fármacos havido alguns com efeitos benéficos. Estes dados podem, em parte, ser explicados porque nos estudos versus placebo o que foi feito, na realidade, foi acrescentar o fármaco em estudo à terapêutica convencional do centro, demonstrando que provavelmente o efeito aditivo de inotrópicos não traz benefícios na mortalidade da insuficiência cardíaca avançada.
Contudo, na falta de alternativas os agentes inotrópicos e vasopressores continuam a ser essenciais no manuseamento de doentes em choque cardiogénico59, com o objetivo de evitar hipoperfusão tecidual e consequente disfunção multiorgânica, devendo para isso ser mantida uma pressão arterial média acima de 65‐70mmHg60.
Nas guidelines de insuficiência cardíaca europeias61, recomendam nos doentes hipotensos, com hipoperfusão ou em choque a utilização de um inotrópico (dando o exemplo da dobutamina), classe IIa, e a utilização de um vasopressor (noradrenalina ou dopamina) em doentes sob terapêutica com inotrópico, com o objetivo de elevar a pressão arterial e melhorar a perfusão, classe IIb. As guidelines de insuficiência cardíaca americanas (ACC/AHA)62 recomendam, classe I, a utilização de fármacos inotrópicos, sem fazerem referência a nenhum fármaco em específico, quanto a fármacos vasopressores aparecem no texto como podendo ser utilizados, sem classe de recomendação e sem referência a qualquer fármaco em específico.
Assim, atualmente, a utilização dos fármacos para este fim varia de acordo com a experiência dos profissionais de saúde e condições de cada centro, como ficou demonstrado por Xian‐Bo et al.63, sendo sugerido que se devia melhorar a formação médica na área dos agentes vasoativos no choque cardiogénico e uniformizar o tratamento.
Como consequência de tudo o que foi exposto, os autores acreditam que, à luz dos conhecimentos atuais, será recomendável a utilização de fármacos inotrópicos e vasopressores nas doses mínimas e apenas durante o período de tempo estritamente necessário, seguindo‐se o esquema terapêutico proposto no diagrama1.
A noradrenalina, como sugerem as guidelines da Sociedade Europeia de Cardiologia54 e após os dados do estudo SOAP II26, deverá ser o fármaco de escolha em doentes em choque cardiogénico, hipotensos e com vasoplegia. Deverá também ser ponderada a associação de vasopressina naqueles com necessidade de doses elevadas de noradrenalina ou nos doentes instáveis do ponto de vista do ritmo cardíaco, nos quais seja pouco seguro aumentar a dose de noradrenalina.
Quanto aos agentes inotrópicos, deverão ser reservados para situações de baixo débito cardíaco como terapêutica provisória. A dobutamina poderá ser o fármaco a considerar em doentes com disfunção ventricular esquerda isolada, enquanto em doentes com resistência pulmonar elevada e disfunção ventricular direita parece haver benefício na utilização de inibidores da PDE ou levosimendan. Estes dois fármacos são ainda a opção mais pertinente em doentes sob terapêutica prévia com betabloqueante, uma vez que atuam independentemente dos recetores beta‐adrenérgicos.
A adrenalina demonstrou também ser um fármaco que poderá ser utilizado em situações de choque cardiogénico com segurança semelhante aos restantes, sendo, por isso, de ponderar a sua utilização em associação aos descritos caso estes não resultem na subida de pressão arterial.
A dopamina aparenta ser o fármaco com mais efeitos adversos e sem aparentes benefícios, pelo que merece ter cada vez mais, um papel limitado no tratamento de doentes em choque, assim como fica evidente nas guidelines de EAM com supradesnivelamento de ST americanas (ACC/AHA)64, onde não é sugerida a utilização de nenhum inotrópico ou vasopressor específico, mas é salientado que a dopamina deve ser evitada.
O agente inotrópico «ideal» será aquele que consiga aumentar o débito cardíaco e diminuir as pressões de enchimento ventricular, sem efeitos secundários e com redução da mortalidade, continuando a ser um objeto de investigação no tratamento do choque cardiogénico65. O omecamtiv mecarbil é um novo fármaco com resultados promissores na insuficiência cardíaca estável, que apresenta efeito inotrópico ao ativar a miosina cardíaca29. As terapêuticas genéticas constituem outra inovação na área da insuficiência cardíaca, com resultados favoráveis em estudos de fase II66. Aguardam‐se resultados de estudos com estes novos agentes terapêuticos.
No ensaio IABP‐SHOCK II67 ficou demonstrado que cerca de 40% dos doentes em choque sob terapêutica inotrópica ou vasopressora acabam por morrer. A maioria dos doentes em choque cardiogénico falece nos primeiros três dias6,67, sendo por isso necessário, além de instituir a terapêutica farmacológica, ponderar a implantação de dispositivos de suporte circulatório mecânico o mais precocemente possível. Nos estudos com dispositivos de suporte circulatório mecânico68, os resultados descritos em termos hemodinâmicos parecem ser promissores, sendo a sua implantação recomendada nos doentes que permanecem em choque após a instituição de terapêutica inotrópica e vasopressora. Ainda assim, a mortalidade destes doentes permanece elevada, fazendo pensar que nem sempre a instituição destas terapêuticas trará os benefícios pretendidos69,70. Aguardam‐se resultados de ensaios clínicos que indiquem quais os melhores dispositivos em cada situação e qual o momento ideal para a sua implantação.
Em Portugal foram publicados, em 2009, dados do registo nacional de síndromes coronárias agudas71, com 22482 doentes inseridos entre 2002‐2008. Neste registo, 7% dos doentes foram medicados com catecolaminas, 50% dos quais por choque cardiogénico. Apesar da falta de dados no nosso país quanto à utilização de suporte circulatório mecânico, sabe‐se que o número de doentes com acesso a estas terapêuticas é pequeno, sendo, seguramente, benéfica a criação de redes de referenciação para o choque cardiogénico.
ConclusõesO único tratamento que demonstrou diminuição da mortalidade no choque cardiogénico, até à data, foi a revascularização emergente.
A escolha do fármaco, ou combinação de fármacos, mais adequado ao tratamento do choque cardiogénico permanece ainda controversa, sendo necessários mais estudos aleatorizados nesta área.
Os doentes em choque cardiogénico refratário a terapêutica médica têm um prognóstico reservado, podendo alguns beneficiar de terapêuticas de suporte circulatório mecânico.
Conflito de interessesOs autores declaram não haver conflito de interesses.