A associação entre cardiopatia e gravidez é cada vez mais frequente. Ainda que a grande maioria das mulheres com doenças cardíacas tolere as alterações fisiológicas da gravidez, existem patologias cardíacas que se manifestam pela primeira vez durante o estado gravídico e outras que contraindicam totalmente uma gravidez pelo risco materno que lhe está associado. Desta forma, torna‐se premente a criação de equipas multidisciplinares dedicadas à abordagem de mulheres com doença cardíaca que pretendem engravidar ou que já estão grávidas. O objetivo deste artigo é sistematizar, com base no conhecimento atual, a abordagem de mulheres com doença cardiovascular de alto risco durante a gravidez.
The association between heart disease and pregnancy is increasingly prevalent. Although most women with heart disease tolerate the physiological changes of pregnancy, there are heart conditions that manifest for the first time during pregnancy and others that totally contraindicate a pregnancy. It is therefore important to establish multidisciplinary teams dedicated to the management of women with heart disease who intend to become, or who already are, pregnant. The aim of this article is to systematically review current knowledge on the approach to women with high‐risk cardiovascular disease during pregnancy.
O espetro e a prevalência da doença cardíaca na gravidez varia muito entre países. De acordo com os dados mais recentes, cerca de 1 a 4% de todas as gravidezes nos países ocidentais industrializados complicam‐se pela existência de doença cardiovascular (DCV)1. Nestes a incidência tem aumentado, e tal deve‐se à ocorrência da gravidez em idade mais tardia, a uma maior prevalência de fatores de risco cardiovascular em mulheres na idade fértil (hábitos tabágicos, diabetes mellitus, obesidade, hipertensão arterial) e ao número crescente de mulheres com cardiopatias congénitas (CC) corrigidas que atingem a idade adulta. Um estudo que incluiu 13 centros canadienses de cardiologia mostrou que as CC correspondiam a 80% de todas as cardiopatias na gravidez2, enquanto no registo brasileiro do Instituto do Coração (InCor), que incluiu 1000 grávidas com cardiopatia seguidas por um período de 10 anos, a etiologia mais frequente foi a cardiopatia reumática, estando esta presente em mais de metade (55%) dos casos3.
As miocardiopatias são raras, contudo representam uma importante causa de complicações, sendo a miocardiopatia periparto (MPP) responsável pelos eventos adversos mais graves4.
No que respeita à mortalidade relacionada com a gravidez, estudos sugerem que a mortalidade tem aumentado ao longo das últimas décadas, com o número de mortes atribuível à DCV crescente5, sendo atualmente a principal causa de morte materna nos países ocidentais6.
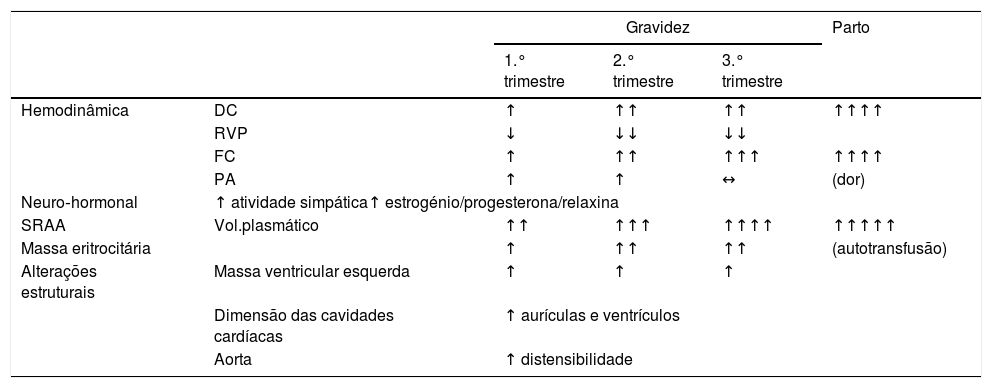
Adaptações hemodinâmicas à gravidezImportantes adaptações do aparelho cardiovascular ocorrem em resposta à gravidez (tabela 1) para suprir as necessidades metabólicas crescentes da mãe e do feto. Alterações hemodinâmicas não adaptativas podem levar a morbilidade materna e fetal7. A incapacidade de adaptação da grávida pode causar descompensação da doença cardíaca prévia, ser responsável pelo início dos sintomas ou levar à primeira manifestação de uma doença até então desconhecida, motivo pelo qual a gravidez é considerada por muitos como o «teste de stress natural».
Alterações fisiológicas da gravidez
| Gravidez | Parto | ||||
|---|---|---|---|---|---|
| 1.° trimestre | 2.° trimestre | 3.° trimestre | |||
| Hemodinâmica | DC | ↑ | ↑↑ | ↑↑ | ↑↑↑↑ |
| RVP | ↓ | ↓↓ | ↓↓ | ||
| FC | ↑ | ↑↑ | ↑↑↑ | ↑↑↑↑ | |
| PA | ↑ | ↑ | ↔ | (dor) | |
| Neuro‐hormonal | ↑ atividade simpática↑ estrogénio/progesterona/relaxina | ||||
| SRAA | Vol.plasmático | ↑↑ | ↑↑↑ | ↑↑↑↑ | ↑↑↑↑↑ |
| Massa eritrocitária | ↑ | ↑↑ | ↑↑ | (autotransfusão) | |
| Alterações estruturais | Massa ventricular esquerda | ↑ | ↑ | ↑ | |
| Dimensão das cavidades cardíacas | ↑ aurículas e ventrículos | ||||
| Aorta | ↑ distensibilidade | ||||
DC: débito cardíaco; FC: frequência cardíaca; PA: pressão arterial; RVP: resistências vasculares periféricas; SRAA: sistema renina angiotensina aldosterona; Vol.: volume.
Adaptado de Sanghavi M et al.7.
O volume de sangue aumenta substancialmente durante a gravidez, de forma rápida entre as 6 e as 20 semanas, e menos pronunciadamente entre as 20 semanas e o termo da gravidez, com um acréscimo médio final de cerca de 50%8. A maior produção de eritropoietina leva a estímulo da eritropoiese, podendo atingir mais de 40% numa grávida sem carências nutricionais9. Contudo, uma vez que o aumento do volume plasmático é superior ao da massa eritrocitária, ocorre hemodiluição, com consequente anemia fisiológica da gravidez. Valores de hemoglobina até 11g/dL são considerados normais7. O débito cardíaco (DC) eleva‐se em cerca de 50%, predominantemente devido ao aumento do volume sistólico (VS) numa fase inicial e à custa do aumento da frequência cardíaca (FC) no 3.° trimestre. Durante a gravidez ocorre redução da resistência vascular periférica (RVP), com consequente diminuição da pressão arterial (PA) sistólica e diastólica. O valor mínimo de PA é atingido durante o 2.° trimestre (redução de 5‐10mmHg do valor inicial), contudo a redução mais acentuada da PA ocorre logo entre as seis e oito semanas de gravidez10. Uma vez que as alterações da PA ocorrem numa fase muito precoce da gravidez, aconselha‐se a comparação dos valores da PA com os valores prévios à gravidez e não com os registados nas primeiras semanas7. O aumento da PA ocorre durante o 3.° trimestre, atingindo novamente os valores pré‐conceção.
No trabalho de parto e no pós‐parto imediato, atinge‐se o pico máximo do DC com aumento de 60‐80%. Tal deve‐se a vários fatores, a destacar: o aumento da FC, o aumento da pré‐carga associada às contrações uterinas (a cada contração uterina 300‐500mL de sangue entram na circulação sistémica) e a elevação das catecolaminas circulantes11. Nesta fase é de extrema importância a manutenção da volemia, devendo acautelar‐se perdas sanguíneas excessivas, uma vez que podem diminuir bruscamente a pré‐carga. Esta é a etapa de maior risco para descompensação da doença cardíaca.
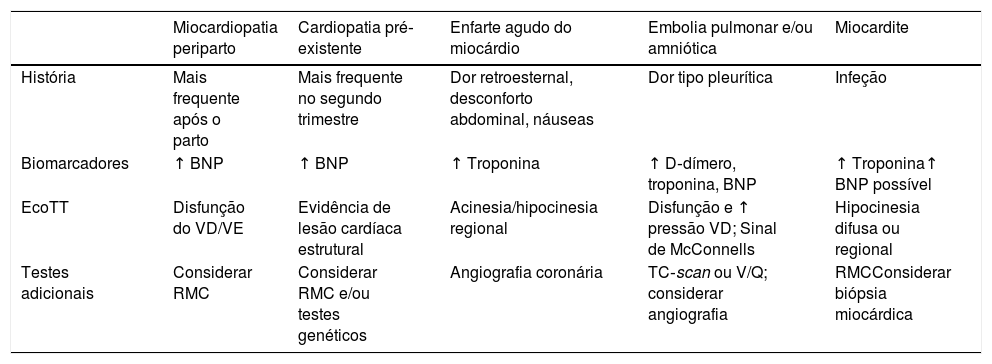
Diagnóstico da doença cardiovascular na gravidezUma história clínica completa é fundamental, com especial atenção na caracterização dos sintomas e sinais associados às alterações fisiológicas da gravidez. Mulheres grávidas saudáveis podem manifestar dispneia para esforços, aumento do cansaço e palpitações. Ao exame físico é frequente a presença de edema dos membros inferiores, ingurgitamento venoso jugular; na auscultação cardíaca é importante destacar que após o 1.° trimestre é audível S1 de maior intensidade, além de um sopro sistólico de ejeção, a presença de S3 e um sopro diastólico auriculoventricular surge em 90%, 80% e 20% dos casos, respetivamente7. Contudo, a manifestação de dor retroesternal, dispneia «de novo», hipotensão sintomática, taquicardia inapropriada, palpitações associadas a lipotimia ou síncope, e cianose devem ser sempre considerados sinais de alarme. O diagnóstico diferencial deve ser baseado numa história clínica pormenorizada e com recurso a exames complementares direcionados à suspeita clínica, pesando o risco versus benefício da sua realização e interpretados no contexto clínico, como exposto na tabela 212.
Diagnóstico Diferencial da Dispneia Aguda
| Miocardiopatia periparto | Cardiopatia pré‐existente | Enfarte agudo do miocárdio | Embolia pulmonar e/ou amniótica | Miocardite | |
|---|---|---|---|---|---|
| História | Mais frequente após o parto | Mais frequente no segundo trimestre | Dor retroesternal, desconforto abdominal, náuseas | Dor tipo pleurítica | Infeção |
| Biomarcadores | ↑ BNP | ↑ BNP | ↑ Troponina | ↑ D‐dímero, troponina, BNP | ↑ Troponina↑ BNP possível |
| EcoTT | Disfunção do VD/VE | Evidência de lesão cardíaca estrutural | Acinesia/hipocinesia regional | Disfunção e ↑ pressão VD; Sinal de McConnells | Hipocinesia difusa ou regional |
| Testes adicionais | Considerar RMC | Considerar RMC e/ou testes genéticos | Angiografia coronária | TC‐scan ou V/Q; considerar angiografia | RMCConsiderar biópsia miocárdica |
BNP: peptídeo natriurético; ECOTT: ecocardiograma transtorácico; RMC: ressonância magnética cardíaca; TC: tomografia computorizada; VD/VE: ventrículo direito e esquerdo.
Adaptado de Bauersachs J et al.12.
O valor preditivo negativo (VPN) dos péptidos natriuréticos mantém‐se durante a gravidez, tendo sido já demonstrado o seu papel na exclusão de doença cardíaca em mulheres grávidas. Contudo, a sua variação e impacto prognóstico em grávidas com doença cardíaca mantém‐se controverso13. A grande maioria das grávidas tem um eletrocardiograma (ECG) normal, mas a elevação do diafragma pelo útero grávido, pode levar a desvio esquerdo do eixo cardíaco de 15‐20°. Outros achados eletrocardiográficos não patológicos possíveis são alterações transitórias do segmento ST e onda T, presença de onda Q e inversão da onda T em DIII, atenuação da onda Q em aVF e inversão da onda T em V1 e V2 e ocasionalmente em V314. O ecocardiograma transtorácico (ECO TT) é o gold standard para a avaliação da função cardíaca durante a gravidez. Os achados não patológicos numa mulher grávida são: ligeira dilatação das quatro cavidades (que pode ser mais pronunciada na aurícula e ventrículo direitos), regurgitação mitral (RM) transitória trivial, regurgitações tricúspide (RT) e pulmonar (RP) fisiológicas7, aumento do DC e da massa ventricular esquerda e direita15. A presença de regurgitação aórtica (RA) é sempre patológica16. O ecocardiograma transesofágico (ECO TE) pode ser útil na caracterização de CC, na suspeita de disseção da aorta e nas disfunções de próteses valvulares (PV), particularmente no diagnóstico de vegetações e trombos. A necessidade de realização de exames com radiação ionizante exige sempre algumas considerações, isto porque apesar de a prioridade ser materna, os efeitos no feto devem ser valorizados. Uma vez que o feto está protegido pelo útero, a dose de radiação tende a ser menor do que a dose à qual a mãe é exposta, contudo o feto é particularmente mais sensível. Os efeitos dependem da dose da radiação e da idade gestacional, devendo ser adiados, sempre que possível, para depois das 12 semanas de gravidez (período de maior organogénese). Não há evidência de que doses < 50 mGy estejam associadas a aumento do risco de aborto, malformações congénitas, restrição de crescimento ou problemas intelectuais. A dose à qual um feto está exposto aquando da realização de uma radiografia de tórax é < 0,01 mGy, contudo só deve ser usada se nenhum outro exame puder esclarecer a etiologia dos sintomas da grávida. A tomografia computorizada raramente é utilizada para diagnóstico de DCV na gravidez e dada a elevada dose de radiação não é recomendada. Uma exceção é a sua realização para tomada de uma conduta essencial para a sobrevida materna, tal como exposto na tabela 2. A ressonância magnética cardíaca (RMC) parece ser segura para mãe e feto17 podendo ser útil na caracterização de cardiopatias complexas e doenças da aorta. O risco para o feto da exposição ao gadolíneo não é conhecido e por isso deve ser evitado14. Também os exames de stress, físico ou farmacológico, devem ser evitados na gravidez pelo risco de hipoxemia, bradicardia fetal e até perda fetal, devido à redução do fluxo placentário.
Na pré‐conceção, a prova de esforço, tem um papel importante na aferição da capacidade funcional, resposta cronotrópica e tensional ao esforço, e arritmias induzidas pelo esforço, no seguimento de doentes com CC e doença valvular assintomática14. No que respeita à ecocardiografia de stress, pode ser útil na avaliação pré‐gravidez da reserva contrátil miocárdica, em mulheres com MPP prévia e recuperação da fração de ejeção (FE), outras miocardiopatias com ligeiro compromisso da FE, doença valvular e CC.
Estratificação de risco da gravidez na presença de DCVA avaliação do risco da gravidez em mulheres com DCV conhecida deve ser sempre individualizada e idealmente realizada antes da gravidez, tal como o ajuste farmacológico, com a suspensão de fármacos contraindicados e introdução de fármacos alternativos. Para estratificação do risco de complicações cardiovasculares maternas têm sido criados vários scores, dos quais o mais utilizado o CARPREG (Cardiac Disease in Pregnancy) risk score18. As orientações da ESC (European Society of Cardiology) recomendam a aferição do risco de complicações cardiovasculares com base na estratificação de risco da Organização Mundial de Saúde (OMS), uma vez que este contempla preditores não incluídos no CARPREG e outros scores de risco (tabelas 3 e 4)14.
Classificação modificada da Organização Mundial de Saúde para o risco cardiovascular materno
| Classe de risco | Risco da gravidez por situação clínica |
|---|---|
| I | Nenhum risco acrescido de mortalidade materna detetado e nenhum aumento ou aumento ligeiro da morbilidade. |
| II | Pequeno risco acrescido de mortalidade materna ou aumento moderado da morbilidade. |
| III | Aumento significativo do risco de mortalidade materna ou morbilidade grave. É necessário aconselhamento especializado. Se for decidido continuar com a gravidez, é necessário acompanhamento cardíaco e obstétrico intensivo, especializado ao longo da gravidez, do parto e do puerpério. |
| IV | Risco extremamente elevado de mortalidade materna ou morbilidade grave; a gravidez é contraindicada. No caso de ocorrer uma gravidez, deve discutir‐se a interrupção voluntária da mesma. No caso de continuação da gravidez, seguir os cuidados da classe III. |
Adaptado de Regitz‐Zagrosek et al.14.
Estratificação de risco cardiovascular materno, modificada pela Organização Mundial de Saúde
| Situações clínicas em que o risco da gravidez é OMS I |
|---|
| Qualquer uma das seguintes desde que não complicadas, pequenas ou ligeiras:‐ estenose pulmonar‐ canal arterial persistente‐ prolapso da válvula mitralLesões simples reparadas com êxito (defeito do septo interauricular ou interventricular, canal arterial persistente, retorno venoso pulmonar anómalo)Extrassístolia isolada auricular ou ventricular |
| Situações clínicas em que o risco da gravidez é OMS II ou III |
|---|
| OMS II (se de resto bem e sem complicações) |
| Defeito do septo interauricular ou interventricular não operado |
| Tetralogia de Fallot tratada |
| A maior parte das arritmias |
| OMS II‐III (dependendo da gestante) |
| Compromisso ligeiro da função do ventrículo esquerdo |
| Miocardiopatia hipertrófica |
| Doença de válvula nativa ou biológica não considerada OMS I ou IV |
| Síndrome de Marfan sem dilatação da aorta |
| Aorta < 45mm em doença da aorta associada a válvula aórtica bicúspide |
| Coartação reparada |
| OMS III |
| Válvula mecânica |
| Ventrículo direito sistémico |
| Circulação de Fontan |
| Cardiopatia cianótica (não tratada) |
| Outras cardiopatias congénitas complexas |
| Dilatação aórtica de 40‐45mm na síndrome de Marfan |
| Dilatação aórtica de 45‐50mm nas doenças da aorta associadas a válvula aórtica bicúspide |
| Situações clínicas em que o risco da gravidez é OMS IV (a gravidez é contraindicada) |
|---|
| Hipertensão arterial pulmonar, seja qual for a causa |
| Disfunção grave do ventrículo sistémico (FEVE <30%, NYHA III‐IV) |
| Miocardiopatia periparto prévia com qualquer nível de compromisso residual da função ventricular esquerda |
| Estenose mitral grave, estenose aórtica grave sintomática |
| Síndrome de Marfan com dilatação da aorta > 45 mm |
| Dilatação aórtica de > 50mm em doença da aorta associada a válvula aórtica bicúspide |
| Coartação nativa grave |
Adaptado de Regitz‐Zagrosek et al.14.
O tipo de parto deve ser decidido e programado por uma equipa multidisciplinar. O tipo de parto privilegiado é o vaginal com um plano individualizado à doente, DCV e ao seu perfil hemodinâmico. A cesariana, embora que controversa, tem indicação nas situações clínicas incluídas no grupo de risco IV da OMS, no trabalho de parto sob anticoagulação oral (ACO), na insuficiência cardíaca (IC) descompensada ou por indicação obstétrica14. Fármacos tocolíticos beta‐agonistas não devem ser utilizados na estenose mitral (EM), uma vez que, ao induzirem taquicardia, diminuem o tempo de enchimento ventricular esquerdo e consequentemente aumentam a pressão na aurícula esquerda. Em alternativa, pode ser utilizado o atosiban, um antagonista da ocitocina. O corticoide é contraindicado em grávidas com doença cardíaca descompensada pelo risco de congestão pulmonar, edema agudo do pulmão e choque cardiogénico.
Profilaxia da endocardite infeciosa (EI)A ESC19 e a ACC/AHA (American College of Cardiology/American Heart Association)20 não recomendam a profilaxia antibiótica durante o parto vaginal ou cesariana. Contudo, a Sociedade Brasileira de Cardiologia mantém a indicação de profilaxia de EI em doentes de alto risco com ampicilina 2g associada a gentamicina 1,5mg/kg uma hora antes do parto. Em doentes alérgicas, a penicilina é substituída pela vancomicina na dose de 1g21.
Doença valvular cardíacaAs lesões valvulares estenóticas e as do lado esquerdo do coração apresentam um risco mais elevado de descompensação na gravidez do que as lesões regurgitantes e as do lado direito. As estenoses valvulares dificultam o aumento do DC, com agravamento do gradiente transvalvular e das pressões a montante da lesão, sendo por isso menos toleradas na gravidez do que as lesões regurgitantes, cujo volume regurgitante diminui face à vasodilatação sistémica e consequente redução da pós‐carga. As PVM estão associadas a problemas específicos, que irão ser abordados.
Apesar de a grande maioria das mulheres com doença valvular menos grave tolerar bem a gravidez, algumas lesões valvulares são consideradas proibitivas: EM grave, estenose aórtica (EA) grave sintomática e qualquer doença valvular associada a disfunção ventricular esquerda e ou hipertensão pulmonar (HTP). Estas devem ser alvo de aconselhamento pré‐concecional e submetidas a intervenções terapêuticas antes de uma eventual gravidez. As alterações hemodinâmicas da gravidez podem levar ao aumento dos gradientes valvulares mitral e aórtico no ECO TT com superestimação da gravidade da lesão valvular22, por este motivo a quantificação da estenose deve ser feita pela área valvular avaliada por planimetria ou pelo tempo de hemipressão para a EM ou pela equação da continuidade para a EA23,24. Para as mulheres que permanecem estáveis durante a gravidez, o parto de termo é recomendado. O parto vaginal com bom manejo da dor é a modalidade preferida para a maioria das mulheres com doença valvular. Alguns peritos sugerem a ponderação da cesariana nas doentes com EA grave14.
Estenose mitralA EM é a doença valvular mais frequente na idade fértil, em 90% dos casos de etiologia reumática. As alterações hemodinâmicas associadas à gravidez (aumento da FC, DC, volume plasmático e massa eritrocitária) levam ao aumento da pressão na aurícula esquerda e consequente edema pulmonar. Muitas doentes tornam‐se sintomáticas pela primeira vez durante a gravidez. As complicações mais frequentes são a diminuição da capacidade funcional, arritmias (mais frequentemente fibrilhação auricular – FA) e edema agudo do pulmão (EAP). Estas estão relacionadas com a área da válvula mitral e classe NYHA24 e ocorrem mais frequentemente no 2.° e 3.°trimestres, quando as alterações hemodinâmicas são mais acentuadas25. Se sintomática, devem ser iniciados beta‐bloqueadores (para prolongamento do tempo de enchimento ventricular e diminuição da pressão na aurícula esquerda) e, se necessário, diuréticos (para alívio da congestão). A anticoagulação (AC) está indicada na presença de FA, trombos auriculares ou antecedentes de embolia. A comissurotomia percutânea deve ser ponderada apenas quando, apesar do tratamento médico, as doentes se mantenham em classe III/IV da NYHA, e idealmente após as 20 semanas de gravidez. A cirurgia cardíaca deve reservar‐se para situações de perigo de vida, quando todas as outras intervenções falharam14.
Regurgitação mitralAs causas mais frequentes de RM neste grupo são a doença valvular reumática, o prolapso da válvula mitral e a CC. A diminuição da RVP e da PA durante a gravidez justificam o facto de mulheres com RM ligeira, moderada ou até grave, sem dilatação do ventrículo esquerdo (VE) e sem compromisso da função deste, tolerarem tão bem a gravidez. Contudo o aumento do volume plasmático e DC podem levar a IC ou arritmias, nomeadamente nos casos de RM grave e nas doentes com dilatação ou disfunção do VE22.
Estenose aórticaA válvula aórtica bicúspide é a principal causa de EA em mulheres na idade fértil, e frequentemente associa‐se a dilatação e coartação da aorta, o que confere risco adicional à gravidez. A EA ligeira a moderada geralmente é bem tolerada, ao contrário da EA grave, que se associa a angor, taquiarritmias e EAP. Ao contrário da EM, na EA não há nenhuma terapêutica farmacológica efetiva. A congestão pulmonar pode ser aliviada com diuréticos, contudo estes devem ser evitados ao máximo pelo risco de hipotensão e redução do fluxo placentário. Diante de sinais e sintomas de IC, síncope ou angor o tratamento indicado é a intervenção percutânea ou cirúrgica26.
Regurgitação aórticaÀ semelhança da EA, a causa mais frequente de regurgitação aórtica (RA) em mulheres jovens é a válvula aórtica bicúspide. Mulheres com RA grave e função sistólica conservada geralmente toleram bem a gravidez. Contudo RA grave associada a disfunção ventricular esquerda, pelo aumento do DC e volume plasmático, é mal tolerada. Grávidas sintomáticas devem receber terapêutica para IC.22
Estenose pulmonarA estenose pulmonar (EP) isolada surge mais frequentemente em contexto de anomalias congénitas da válvula pulmonar. Mesmo em mulheres com EP grave, as complicações cardíacas (IC e baixo débito) durante a gravidez são raras, mas se presentes podem ser tratadas com valvuloplastia percutânea com bons resultados em qualquer idade gestacional27. Complicações não cardíacas têm sido descritas tais como distúrbios hipertensivos, prematuridade e complicações tromboembólicas28.
Regurgitação tricúspideAs causas de RT primária, não trivial, em mulheres jovens são: CC (por exemplo, a anomalia de Ebstein que, de acordo com a sua complexidade, pode mudar o prognóstico da doente), doença valvular reumática e a EI. A RT geralmente é bem tolerada durante a gravidez. Contudo nas CC, com ou sem correção cirúrgica, nas quais a válvula tricúspide é a única válvula auriculoventricular, esta torna‐se insuficiente e associa‐se a dilatação e disfunção ventricular, o que aumenta o risco da gravidez29.
Próteses valvularesAquando da substituição de uma válvula nativa por PV numa mulher que poderá vir a engravidar, o risco benefício de colocação de uma PV biológica (PVB), risco de deterioração da estrutura e menor durabilidade, com 90% de reintervenção para substituição da prótese aos 15 anos30, mas sem necessidade de anticoagulação, versus PVM, maior durabilidade e melhor perfil hemodinâmico mas maior risco de tromboembolismo e consequente necessidade de AC ad eternum, deve ser ponderado. A gravidez geralmente é bem tolerada em portadoras de PVB, estando o risco cardiovascular materno dependente da função valvular e ventricular (comparável ao da doença valvular nativa). O controlo da gravidez é semelhante ao praticado na doença da válvula nativa. No caso das PVM, está acrescido o risco de trombose valvular, complicações hemorrágicas e complicações para o feto.
Um estudo retrospetivo, publicado em 2015, de 84 grávidas com doença valvular (23 das quais com PV), demonstrou que a gravidez em mulheres portadoras de PV associou‐se a elevada morbilidade materna e fetal31. Também em 2015 a ESC, publicou os outcomes da gravidez em mulheres portadoras de PV – ROPAC (Registry Of Pregnancy And Cardiac disease) 32. Neste registo foram incluídas 212 doentes com PVM, 134 com PVB e 2620 sem próteses. A mortalidade materna foi de 1,5% no grupo com PV e 0,2% nas mulheres sem PV (p = 0,025). A trombose de prótese ocorreu em 10 mulheres com PVM, tendo sido também mais frequente neste grupo as complicações hemorrágicas (23% versus 5% em mulheres com PB e sem próteses, p < 0,001). A sobrevida livre de eventos foi de 78% nas grávidas sem PV, 79% nas com PB e de apenas 58% nas grávidas com PVM (p = 0,001). Também o outcome dos fetos de mães com PVM foi pior, com uma incidência significativamente maior de aborto espontâneo, morte e menor peso ao nascimento. Neste sentido, muitos especialistas preferem a substituição da válvula nativa por PVB em mulheres que desejam engravidar, não só pelos menores riscos a que estas se associam, mas também por inúmeros estudos terem já demonstrado que a gravidez não influencia a degeneração das PB33, e pelo facto de estas permitirem o tratamento percutâneo valve in valve, que se adivinha como o futuro em doentes de risco intermediário e alto.
AnticoagulaçãoA gravidez é um estado pró‐trombótico, não só pela estase venosa a que esta se associa, mas também pela hipercoagulabilidade resultante dos níveis crescentes de fatores trombogénicos ao longo da gravidez34. Contudo as complicações maternas e fetais associadas aos vários regimes de AC, a ausência de estudos randomizados e de recomendações consensuais têm dificultado o seu manejo durante a gravidez22.
A varfarina, um antagonista da vitamina K, atravessa a placenta, e o seu uso nas primeiras 6 a 12 semanas de gravidez associa‐se a complicações fetais, tais como embriopatia (1 a 30%) e aborto (15 a 56%)22, e durante toda a gravidez a maior incidência de aborto e de hemorragia intracraniana no feto31, cuja incidência é variável consoante os estudos35,36. Contudo, quando mantida durante toda a gravidez, oferece a melhor proteção tromboembólica em mulheres portadoras de PVM. Estudos realizados por um grupo de investigadores, ainda que com número muito reduzido de doentes, mostraram que o risco de toxicidade fetal é inferior quando a AC terapêutica é atingida com doses diárias de varfarina ≤ 5mg/dia versus doses superiores37,38. Com base nestes achados, a ESC e ACC/AHA apoiam a toma de varfarina em doses diárias < 5mg/dia (ou femprocumona < 3mg/dia ou acenocumarol < 2mg/dia) durante toda a gravidez, considerando‐a uma terapêutica segura (ESC – classe IIa nível C, AHA/ACC – classe IIa nível B)14,39. Quando a dose necessária para atingir o INR‐alvo for superior às acima mencionadas, é recomendada a substituição por heparina de baixo peso molecular (HBPM) ou heparina não fracionada (HNF) contínua durante o primeiro trimestre, a fase crítica da organogénese. Contudo esta abordagem é discutível, isto porque outros trabalhos demonstraram que a varfarina mesmo em doses baixas associa‐se a mortalidade fetal40.
A AHA/ACC recomenda a utilização de aspirina diária (75‐100mg/dia) em associação com a varfarina durante o 2.° e 3.° trimestres39.
A HNF não atravessa a placenta, não tendo assim efeitos diretos sobre o feto. A sua administração subcutânea não é efetiva, não sendo portanto recomendada pelo risco de complicações tromboembólicas41, contudo a HNF intravenosa é a forma mais adequada de AC no pré e pós‐parto devido ao seu rápido início de ação e rápida eliminação.
A HBPM à semelhança da HNF não atravessa a placenta, mas apresenta melhor perfil de segurança (maior biodisponibilidade e tempo de semi‐vida, menos hemorragia, e menor risco de indução de trombocitopenia)41. A sua eficácia durante a gravidez é discutível. Alguns estudos demonstraram eficácia semelhante à varfarina em mulheres portadoras de PM se administrada na dose correta, que consiste em administração bidiária, com base no peso corporal materno e avaliação dos níveis de anti‐Xa 4‐6horas após administração, com valor‐alvo de 0,8‐1,2 U/mL36. Contudo, um estudo com 15 grávidas com administração de dose plena de HBPM (1mg/kg±20% subcutânea, bidiária) mostrou que nem em 50% dos casos foi atingido níveis terapêuticos de fator anti‐Xa e com grande variação dos níveis deste entre administrações42.
A suspensão da varfarina deve ocorrer pelo menos uma semana antes do parto, em ambiente hospitalar, devendo ser realizado switch para HBPM ou HNF. No caso de a varfarina ser substituída por HBPM, esta deve ser suspensa 36 horas antes do parto e iniciada HNF. Por sua vez, a HNF só deverá ser suspensa 4‐6horas do parto e reiniciada 6 a 8 horas após, se asseguradas condições de hemostase. A reintrodução da varfarina varia entre centros mas deverá ser reiniciada 48 horas após o parto.
A utilização dos novos ACO tem sido crescente em mulheres não grávidas. Recentemente, a FDA (Food and Drug Administration) aprovou o rivaroxabano como classe C na gravidez, mas até ao momento não há relato na literatura da sua utilização43.
Cardiopatia congénita complexaAs CC correspondem a 80% da patologia cardíaca em mulheres grávidas no mundo ocidental44. Algumas subcategorias de CC, tais como a circulação de Fontan, ventrículo direito sistémico e CC cianóticas não corrigidas associam‐se a elevado risco materno e fetal. Nas doentes com circulação de Fontan, 10% das gravidezes associam‐se a complicações maternas, a mais frequente das quais as arritmias, podendo também ocorrer complicações tromboembólicas e agravamento da IC45,46. É consensual que doentes com Fontan com compromisso da função ventricular, regurgitação auriculoventricular grave e enteropatia devem ser desaconselhadas a engravidar14. As mulheres com ventrículo direito sistémico (pós‐cirurgia de Mustard ou Senning ou transposição dos grandes vasos congenitamente corrigida) acarretam risco de complicações cardíacas semelhantes, entre 10‐30%, devendo ser avaliadas antes da gravidez. A gravidez deve ser desencorajada na presença de disfunção ventricular direita ou RT graves14. Nas CC cianóticas não corrigidas sem HTP, a gravidez associa‐se a 32% de complicações (mais frequentemente IC). O outcome fetal está diretamente relacionado com a saturação de oxigénio da mãe em repouso (saturação ≤ 85% associa‐se a sobrevivência fetal de apenas 12%)47.
Hipertensão pulmonarA HTP associa‐se a mortalidade materna elevada, mas os avanços no desenvolvimento de terapêuticas vasodilatadoras pulmonares específicas (TVPE) apontam para uma melhor expetativa de prognóstico48. De todos os grupos de HTP, o que se associa a melhor prognóstico é a HAP idiopática sob terapêutica específica (9% de mortalidade) 49. Dentro deste grupo, as mulheres com HAP vasorreativa estáveis sob terapêutica com bloqueadores dos canais de cálcio têm relativamente bom prognóstico durante a gravidez50.
Apesar da melhoria no prognóstico observado nas últimas décadas em mulheres com HTP, esta patologia mantém‐se associada a elevada mortalidade, sendo considerada pela OMS como risco IV. Não dispondo até à data de critérios para identificação das mulheres com menor risco durante a gravidez, esta é desaconselhada a todas as mulheres com diagnóstico estabelecido de HTP14. Quando a mulher decide dar continuidade à gravidez, deve ser encaminhada para um centro especializado em HTP e seguida por uma equipa multidisciplinar. A TVPE em uso antes da gravidez deve ser continuada, à exceção dos antagonistas dos recetores da endotelina (bosentan, macicentan e ambrisentan), que são teratogénicos, devendo ser substituídos por sildenafil e ou derivados das prostaciclinas.
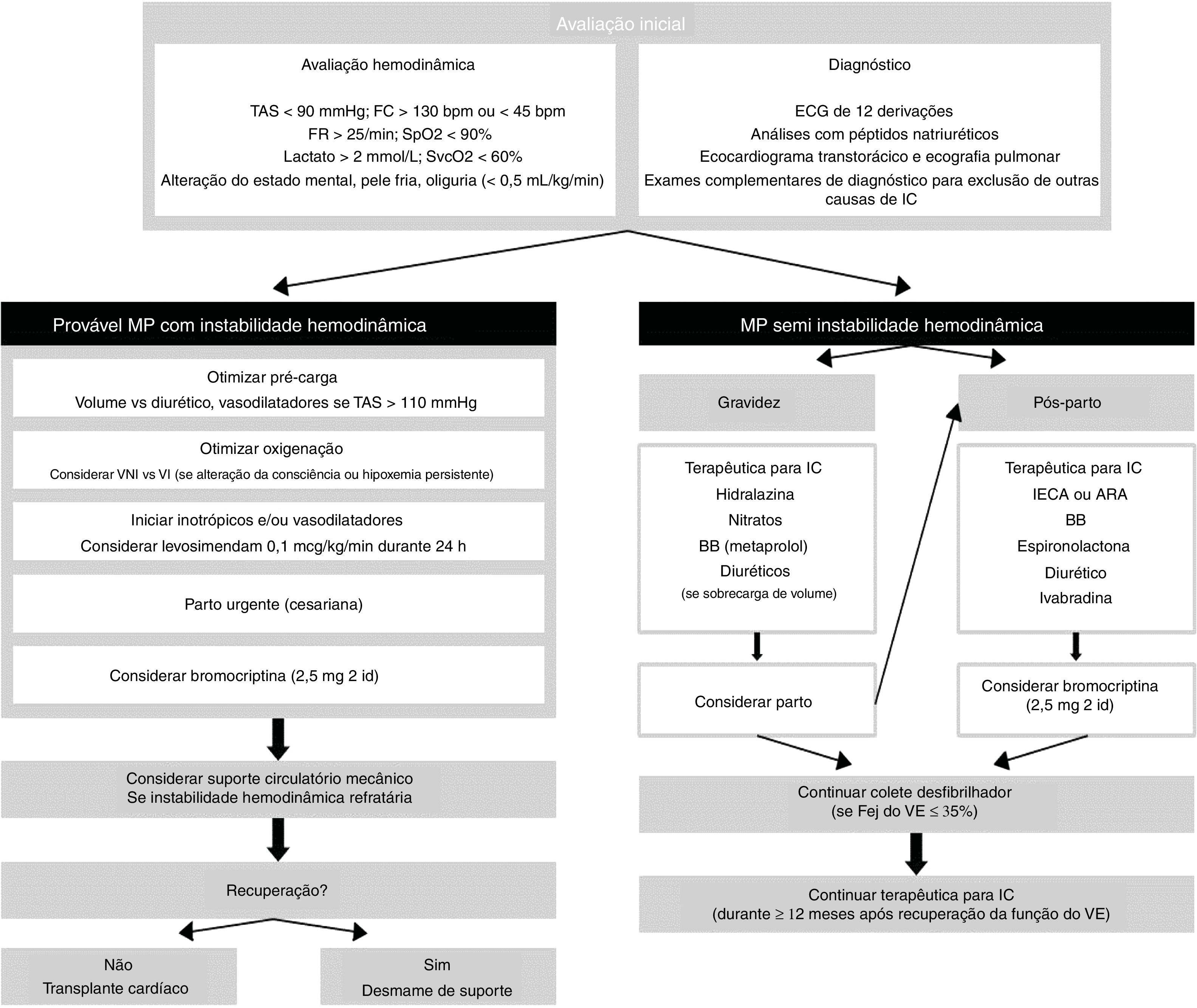
Miocardiopatia peripartoO grupo de trabalho da MPP da ESC propôs, em 2010, uma definição simplificada desta entidade, como uma miocardiopatia idiopática frequentemente manifestada por IC secundária a disfunção sistólica (Fej < 45%) que ocorre no final da gravidez ou nos primeiros meses pós‐parto, após exclusão de outras causas de IC.51 Uma vez que não dispomos, até ao momento, de nenhum exame de diagnóstico específico para a MPP, esta permanece sempre como diagnóstico de exclusão devendo ser diferenciada de doença cardíaca prévia descompensada pelas alterações hemodinâmicas subjacentes à gravidez. Os dados epidemiológicos referentes a esta entidade são escassos, sendo maioritariamente referentes à Nigéria, África do Sul, Haiti, onde a incidência é maior, e Estados Unidos da América, onde a incidência tem vindo a aumentar52. Em 2017,K Sliwa et al. publicaram os dados recolhidos entre 2012 e 2016 no EURObservational Research Programme53, onde demonstraram que a MPP ocorre em mulheres de todo o mundo, com diferentes origens étnicas e condições socioeconómicas, mas com formas de apresentação e evolução muito semelhantes. Os fatores de risco que têm sido apontados são a descendência afroamericana, idade materna avançada, gravidezes multifetais e distúrbios hipertensivos durante a gravidez52. Apesar da etiologia permanecer desconhecida, várias hipóteses têm sido colocadas, como baixos níveis de selénio, reativação de infeções virais latentes, ativação de citocinas pelo stress, inflamação, reação autoimune, resposta patológica ao stress hemodinâmico e desequilíbrio do stress oxidativo54. Recentemente foi descrito um novo e potencial fator causal, a clivagem da prolactina num fragmento ativo, prolactina 16‐kDa, mediada pelo stress oxidativo55. O efeito antiangiogénico do fragmento 16‐kDa da prolactina e do sFlt1 (soluble fms‐like tyrosine kinase‐1), cujos níveis estão também elevados nesta patologia, pode alterar o equilíbrio da angiogénese, promovendo a lesão vascular e consequente IC54. A elevada incidência de MPP em africanos e a história familiar positiva em 16% dos casos tem sugerido uma eventual causa genética56, mas as mutações documentadas até ao momento estão associadas a formas familiares de miocardiopatia. A maioria das doentes admitidas com MPP apresenta sintomas e sinais típicos de IC. O diagnóstico diferencial deve ser feito com outras entidades como miocardite, miocardiopatia pré‐existente, doença cardíaca valvular ou congénita. No caso de apresentação sob a forma de choque cardiogénico deve excluir‐se de imediato enfarte agudo do miocárdio e tromboembolismo pulmonar (TEP)12. O ECG deve ser realizado a todas as doentes com suspeita de MPP, ainda que não exista nenhum padrão eletrocardiográfico específico, mas pelo seu elevado VPN. Geralmente os níveis de NT pro‐BNP estão elevados, podendo ser utilizado na exclusão de dispneia de causa não cardíaca, contudo não é útil na diferenciação da MPP de outras miocardiopatias. O ECO TT deve ser realizado o mais precocemente possível em todos os casos de suspeita de MPP, para exclusão de outra doença cardíaca, complicações (por exemplo, trombo apical) e obter informações prognósticas. Apesar de o prognóstico ser mais favorável na MPP do que em outras miocardiopatias, esta associa‐se a mortalidade (< 5‐50%) e morbilidade (EAP, choque cardiogénico, arritmias e eventos tromboembólicos) não desprezáveis12. O risco de morte associa‐se a idade materna avançada, multiparidade, grave compromisso da função sistólica global, descendência afroamericana e atraso no diagnóstico4. A percentagem de doentes que recupera a função ventricular esquerda (FE ≥ 50%) varia consoante os estudos (35‐70%), contudo, na grande maioria esta ocorre nos primeiros seis meses após parto52. De acordo com os dados mais recentes, a descendência afroamericana e quanto menor a FE e maior o volume telediastólico do VE, aquando do diagnóstico, associam‐se a menor probabilidade de recuperação57. No que respeita a gravidezes subsequentes, as mulheres com disfunção ventricular esquerda persistente têm maior risco (≈50%) de deterioração clínica do que as que recuperaram por completo a função ventricular, contudo, nestas últimas não é garantida a ausência de recorrência numa outra gravidez (cerca de 20% agrava a função cardíaca, que persiste no pós‐parto em 20 a 50%)58. Do ponto de vista terapêutico, a abordagem da MPP é semelhante à de outras causas de IC aguda, com atenção na prevenção dos efeitos secundários no feto. Na figura 1 apresenta‐se a proposta de um algoritmo de tratamento, de acordo com a estabilidade hemodinâmica da doente. Em doentes com instabilidade hemodinâmica é fundamental uma abordagem rápida e sistematizada, de forma a dar suporte e evitar lesões de órgão‐alvo. Esta é uma das poucas situações em que se indica a cesariana de emergência para tratar a mãe, com o intuito de se iniciar bromocriptina59. No que respeita ao suporte inotrópico, neste grupo de doentes, a utilização de levosimendan tem sido apontada como preferencial por não aumentar o consumo miocárdico de oxigénio, devendo ser evitada a utilização de catecolaminas. Contudo, na ausência de levosimendan, a dobutamina é o inotrópico de escolha e como agente vasopressor deve ser usada a noradrenalina12. Durante a gravidez os inibidores da enzima conversora da angiotensina (IECA), os bloqueadores dos recetores da angiotensina e os inibidores da renina estão contraindicados pela toxicidade fetal que lhes é inerente. Em alternativa, para a redução da pré e pós‐carga, podem ser utilizados, respetivamente, os nitratos e a hidralazina. Após o parto, os IECA podem ser reiniciados, com preferência no captopril e enalapril durante o período de aleitamento. Os beta‐bloqueadores, apesar de aumentarem o risco de restrição do crescimento intra‐uterino podem ser usados em doentes hemodinamicamente estáveis, de preferência os β1 seletivos (por exemplo, metoprolol succinato). Os antagonistas dos recetores dos mineralocorticoides devem ser evitados na gravidez e aleitamento14. A bromocriptina, em associação à terapêutica da IC, deve ser considerada atendendo aos resultados promissores na recuperação da função sistólica do VE e melhoria clínica60. Num registo retrospetivo alemão de MPP, o tratamento com beta‐bloqueadores, IECA e bromocriptina (2,5mg duas vezes ao dia durante duas semanas seguido de 2,5mg uma vez dia por seis semanas) associou‐se a resultados favoráveis61. Deve ser iniciada AC com heparina em doentes com MPP sob bromocriptina e/ou com Fej ≤ 35% (durante a gravidez e pelo menos nas oito semanas pós‐parto)62,63. A terapêutica anti‐remodelling ventricular deve ser continuada pelo menos 12 meses após a recuperação das dimensões e função do ventrículo esquerdo. Apesar de a principal causa de morte ser por IC, um quarto das mortes ocorre por arritmia ventricular, mais frequentemente nos primeiros seis meses64. A utilização de coletes desfibrilhadores nos primeiros seis meses após diagnóstico de MPP tem sido proposta em mulheres com grave compromisso da função ventricular, como ponte até recuperação da função ou implantação de cardioversor desfibrilhador65.
Algoritmo de abordagem inicial de doentes com MP (miocardiopatia periparto). ARA: antagonista do recetor da angiotensina; BB: beta‐bloqueadores; ECG: eletrocardiograma; FC: frequência cardíaca; Fej: fração de ejeção; FR: frequência respiratória; IC: insuficiência cardíaca; IECA: inibidor da enzima conversora da angiotensina; SpO2: saturação periférica de oxigénio; SvcO2: saturação central de oxigénio; TAS: tensão arterial sistólica; VE: ventrículo esquerdo; VI: ventilação invasiva; VNI: ventilação não invasiva. Adaptado de Bauersachs et al.12.
A associação entre cardiopatia e gravidez é muito frequente. A gravidez impõe várias adaptações que nem sempre são toleradas pelas doentes com doença cardíaca prévia. Assim, a avaliação e o seguimento de mulheres com doença cardíaca conhecida ou suspeita que pretendem engravidar deve começar antes da gravidez de forma que se possa estratificar o risco individual e programar de forma antecipada os cuidados a ter. O desenvolvimento de patologia cardiovascular na grávida é também uma situação que deve ser excluída na fase de seguimento da gravidez e, quando detetada, implicar o envolvimento imediato da equipa cardiológica. É prática cada vez mais comum, e recomendada, haver equipas dedicadas a este tipo de patologias, traduzindo‐se em melhores resultados clínicos.