A síncope define‐se como uma perda transitória do conhecimento devido a hipoperfusão cerebral global e representa uma das principais causas de vinda ao Serviço de Urgência. Na abordagem inicial do doente neste contexto é fundamental estratificar o risco para síncope de causa cardíaca, promovendo um adequado estudo etiológico e orientação terapêutica. A etiologia mais comum é o reflexo vasovagal, o qual parece resultar de uma resposta autonómica paradoxal com consequente hipotensão e/ou bradicardia. Ainda que a síncope vasovagal seja uma condição sem impacto na mortalidade, esta frequentemente afeta uma população jovem e causa uma morbilidade significativa, sobretudo quando associada uma elevada taxa de recorrência. Na abordagem terapêutica da síncope incluem‐se estratégias não‐farmacológicas comportamentais e terapêuticas farmacológicas que atuam nos vários níveis do arco reflexo desencadeante do episódio sincopal. Contudo, ambas são suportadas apenas por evidência de robustez limitada. Nos casos em que estas intervenções se mostram insuficientes, o uso de pacemaker definitivo tem sido proposto como estratégia terapêutica, agora com maior força de robustez nas atuais Recomendações europeias. Os estudos iniciais não‐aleatorizados e sem ocultação demonstravam um potencial benefício de tal intervenção, com redução da recorrência de episódios sincopais. Contudo, os estudos aleatorizados e de dupla ocultação têm resultados díspares. Tendo por base as diferenças destes estudos, os autores efetuaram uma revisão abrangente da literatura acerca da evidência do pacing cardíaco e respetivos algoritmos e quais os fatores a considerar na decisão diagnóstica e terapêutica individualizada, no doente com síncope vasovagal recorrente.
Syncope is defined as a transient loss of consciousness due to global cerebral hypoperfusion and is one of the leading causes of emergency department admission. The initial approach should focus on excluding non‐syncopal causes for loss of consciousness and risk stratification for cardiac cause, in order to ensure an appropriate etiological investigation and therapeutic approach. Vasovagal syncope (VVS), the most common type of syncope, should be assumed once other causes are excluded. Pathophysiologically, the vasovagal reflex is the result of a paradoxical autonomic response, leading to hypotension and/or bradycardia. VVS has not been shown to affect mortality, but morbidity may be considerable in those with recurrent syncopal episodes. The management of VVS includes both non‐pharmacological and pharmacological measures that act on various levels of the reflex arc that triggers the syncopal episode. However, most are of uncertain benefit given the scarcity of high‐quality supporting evidence. Pacemaker therapy may be considered in recurrent refractory cardioinhibitory reflex syncope, for which it is currently considered a robust intervention, as noted in the European guidelines. Non‐randomized and unblinded studies have shown a potential benefit of pacing in recurrent VVS, but double‐blinded randomized controlled trials have not consistently demonstrated positive results. We performed a comprehensive review of the current literature and recent advances in cardiac pacing and pacing algorithms in VVS, and discuss the diagnostic and therapeutic approach to the complex patient with recurrent VVS and reduced quality of life.
A síncope é definida como uma perda transitória de conhecimento, de curta duração, secundária a hipoperfusão cerebral global, a qual se acompanha de recuperação espontânea1,2. Atualmente, a síncope constitui um dos principais motivos de recorrência ao Serviço de Urgência (1‐3% de todas as causas), com subsequente internamento para investigação etiológica em aproximadamente 40% dos casos3,4. O mecanismo fisiopatológico reflexo vasovagal ou neurogénico constitui a principal etiologia do episódio sincopal5, traduzindo‐se em morbilidade importante, ainda que sem impacto na taxa de mortalidade6.
A importância da discussão da temática da síncope reflexa deve‐se à sua elevada prevalência e incidência, marcada morbilidade, assim como a importantes lacunas do conhecimento acerca da sua abordagem terapêutica. Deste modo, esta revisão tem como objetivos abordar as seguintes problemáticas: (i) definição de perda de conhecimento e diagnóstico diferencial da síncope; (ii) mecanismos fisiopatológicos da síncope reflexa, nomeadamente cardio‐inibitória e vasodepressora; (iii) diagnóstico diferencial do bloqueio auriculoventricular (AV) de causa extrínseca e de causa intrínseca; (iv) revisão sumária da abordagem terapêutica, com especial enfoque no potencial papel do pacemaker definitivo (PMD).
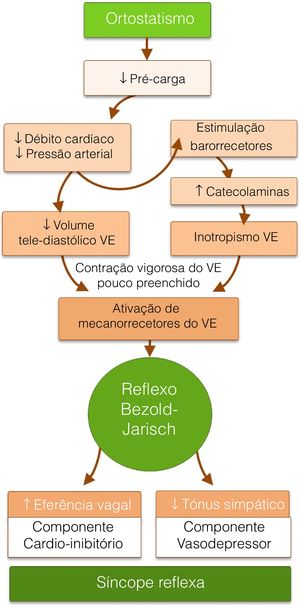
FisiopatologiaO mecanismo subjacente à síncope reflexa é um reflexo autonómico paradoxal que resulta em hipotensão (vasodepressão) e/ou bradicardia (cardio‐inibição) (fig. 1), iniciando‐se perante um determinado estímulo e respetiva aferência, que culmina numa resposta eferente com aumento do tónus parassimpático e/ou inibição do tónus simpático. Em determinadas circunstâncias, o estímulo inicial é identificado (por exemplo, hipersensibilidade do seio carotídeo), ao passo que noutras é desconhecido e frequentemente associado ao stress ortostático7.
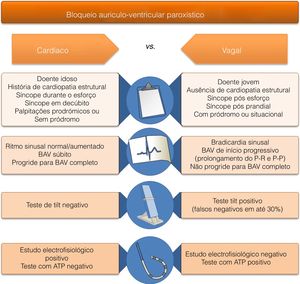
O ortostatismo provoca diminuição do retorno venoso, com consequente redução do débito cardíaco, pressão arterial (PA) e volume telediastólico. O arco reflexo neuronal normal, que mantém a perfusão cerebral e previne a síncope nesta situação, é constituído por três componentes. Os barorrecetores do seio carotídeo, do arco aórtico e do ventrículo esquerdo (VE) enviam estímulos aferentes, em resposta à diminuição da pressão, para o centro vasomotor no bulbo. Da integração desta resposta resulta um envio de estímulos eferentes que aumentam o tónus simpático e as catecolaminas circulantes e diminuem o tónus parassimpático, com consequente vasoconstrição e efeitos cronotrópico e inotrópico positivos. Os desencadeantes associados à resposta paradoxal dos doentes com SVV parecem ser a redução do volume telediastólico VE e o aumento da secreção de catecolaminas. A contração vigorosa de um VE depletado de volume, desencadeada pela ação catecolaminérgica, promove a estimulação dos mecanorreceptores aí presentes (fibras C não‐mielinizadas distribuídas pelas quatro câmaras cardíacas). Este estímulo aferente projeta‐se no núcleo dorsal do vago, no bulbo, resultando num estímulo eferente que, paradoxalmente, reduz o tónus simpático e/ou aumenta o parassimpático, com consequente efeito vasodepressor (hipotensão) e/ou cardio‐inibitório (bradicardia), respetivamente (reflexo de Bezold‐Jarisch)8. A hipotensão e a bradicardia, com consequente hipoperfusão cerebral, são responsáveis pela perda de conhecimento. Uma vez que, tanto o nódulo sinoauricular como o nódulo AV têm uma importante componente de inervação autonómica, a bradicardia, neste contexto, poderá ser causada pelo aumento do estímulo vagal com redução da automaticidade do nódulo sinoauricular e diminuição da condução no nódulo AV, com consequente bloqueio AV (fig. 2 e tabela 1). De notar que tanto a hiperatividade vagal extrínseca assim como a doença intrínseca do sistema de condução podem ser causa de bloqueio AV e síncope, tornando‐se fundamental a sua distinção pelas suas diferentes implicações terapêuticas e prognósticas.
Diagnóstico diferencial do bloqueio AV de causa extrínseca versus causa intrínseca, com base em dados da história clínica, exame objetivo e exames complementares de diagnóstico
| Bloqueio AV de Causa Intrínseca(Sinais de alarme que sugerem a etiologia cardíaca) | Bloqueio AV de Causa Extrínseca(Sinais de segurança que reforçam a etiologia reflexa) |
|---|---|
| História Clínica | |
| • Primeiro episódio de síncope em idade mais avançada• Cardiopatia estrutural conhecida• História familiar de morte súbita (cardíaca)• Síncope sem pródromos (ou curto com palpitações)• Síncope durante o esforço• Síncope sentado ou em decúbito | • Episódios recorrentes de síncope na mulher em idade jovem• Sem cardiopatia estrutural conhecida• Sem história familiar de morte súbita• Pródromos marcados• Síncope após o esforço ou com o stress ortostático |
| Eletrocardiografia | |
| • Intervalo P‐P inalterado ou reduzido durante a fase de bradicardia ou assistolia | • Intervalo P‐P aumentado durante a fase de bradicardia ou assistolia |
| • Bradicardia ou assistolia de início rápido | • Intervalo P‐P com aumento progressivo previamente a bradicardia ou assistolia |
| • ECG em repouso anómalo (BCRE, BCRD com HBFA, QT curto ou longo, BAV Mobitz tipo II ou superior, padrão de Brugada, síndrome de Haïssaguerre, FA, onda delta, onda épsilon) | • ECG em repouso normal |
AV = Auriculoventricular; BAV = Bloqueio Auriculoventricular; BCRD = Bloqueio Completo de Ramo Direito; BCRE = Bloqueio Completo de Ramo Esquerdo; ECG = Eletrocardiograma; FA = Fibrilhação Auricular; HBFA = Hemi‐Bloqueio Fascicular Anterior.
A síncope pode surgir por um efeito puramente vasodepressor ou, menos frequentemente, apenas cardio‐inibitório9 dependendo da resposta eferente com inibição do tónus simpático ou por aumento do tónus parassimpático, respetivamente. No estudo VASIS10, a componente cardio‐inibitória foi definida segundo os seguintes subgrupos: (2A) a frequência cardíaca (FC) aumenta inicialmente, diminuindo posteriormente abaixo de 40 batimentos por minuto (bpm) por mais de 10 segundos ou até assistolia por mais de três segundos, com a PA a aumentar inicialmente e depois a diminuir antes da queda da FC; (2B) a FC tem o mesmo comportamento, ao passo que a PA desce até níveis de sistólica inferiores a 80mmHg no momento ou após o início da descida da FC. De qualquer modo, a resposta mista, na qual geralmente a hipotensão antecede a bradicardia, parece ser a mais frequentemente observada.
Os sinais que precipitam as referidas respostas eferentes ainda não estão totalmente esclarecidos, sendo a investigação em humanos limitada e permanecendo um desafio7–11. Ainda assim, e sobretudo com base em estudos animais, parece haver mais do que um mecanismo responsável. Pequenos estudos caso‐controlo, que incluíram doentes com teste de tilt (TT) positivo e avaliação ecocardiográfica simultânea, mostraram uma diminuição do volume ventricular esquerdo no decorrer do exame, apoiando este conceito de ventrículo vazio12,13. No entanto, outros trabalhos similares não corroboraram a existência de hipercontratilidade ou aumento da pressão sistólica no VE, no período inicial do TT14, apoiando a ideia de que a estimulação mecânica do VE não será um mecanismo essencial no arco reflexo de, pelo menos, todas as formas de SVV14. A interrupção das fibras C ventriculares, em animais, preveniu a hipotensão e bradicardia, em resposta à hemorragia aguda. Contudo, tal não se verificou num estudo experimental semelhante em cães11. Adicionalmente, existem registos de doentes submetidos a transplante cardíaco, que posteriormente tiveram síncopes vasovagais, apesar de não haver evidência de re‐inervação significativa do coração transplantado e, portanto, nestes doentes a estimulação autonómica não será um mecanismo subjacente à síncope15,16. Apesar de ser um estudo experimental realizado com animais e da evidência em humanos ser ainda muito limitada, os aferentes ventriculares, mais uma vez, não parecem ser absolutamente necessários para o desenvolvimento da SVV. Adicionalmente, poderão existir outras estruturas cardiovasculares que, ao serem estimuladas em contexto de hipovolemia, resultam em SVV. No entanto, ainda não existe evidência experimental que corrobore esta teoria17.
Em suma, apesar de o reflexo de Bezold‐Jarisch poder explicar a hipotensão e bradicardia, outros mecanismos deverão ser responsáveis pela SVV recorrente noutros doentes. O papel dos neurotransmissores, tais como opióides endógenos, monóxido de azoto11, adenosina18 e serotonina19, tem sido estudado, e as suas alterações podem resultar em inibição do estímulo simpático. Outra proposta de mecanismo fisiopatológico é a disfunção do barorreflexo central ou periférico17.
No que diz respeito à resposta hemodinâmica que caracteriza a SVV, Jardine et al., no seu trabalho de revisão, propuseram uma sequência de alterações transversais a todos os doentes com SVV. Na fase 1, denominada estabilização precoce, haverá uma diminuição do retorno venoso central (RVC), com consequente diminuição do volume sistólico e do débito cardíaco (DC), apesar do aumento da FC; a PA média é mantida pelo aumento da resistência vascular periférica. A fase 2 (instabilidade circulatória) ocorre quando há um aumento adicional da pressão negativa nos membros inferiores (PNMI), com consequente exacerbação de todos os mecanismos referidos na fase 1. Na fase 3 (hipotensão terminal), com o progressivo aumento da PNMI, a FC e o DC diminuem, a variabilidade da PA desaparece e ocorre o episódio clássico de SVV. A fase de recuperação (fase 4) ocorre rapidamente, após término da PNMI20.
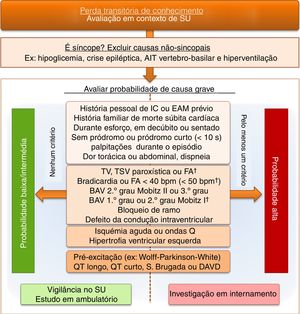
Diagnóstico diferencial da síncope vasovagalNo que diz respeito à abordagem do doente com perda de conhecimento, em contexto de urgência, a SVV deve ser considerada como um diagnóstico de exclusão após investigação etiológica adequada e negativa. Na (fig. 3) é proposta uma abordagem algorítmica compreensiva simplificada ao diagnóstico diferencial do doente com perda de conhecimento que recorre ao Serviço de Urgência. Neste algoritmo enfatiza‐se a importância da exclusão inicial de patologias frequentes e cuja apresentação deve ser diferenciada do episódio sincopal propriamente dito21. Destaca‐se a importância da estratificação de risco para síncope cardiogénica, constituindo esta uma ferramenta simples para identificar o melhor contexto de investigação e orientação terapêutica destes doentes. Apesar de dificilmente se obter um diagnóstico definitivo em contexto de urgência torna‐se vital esta estratificação para que doentes de baixo risco possam ser adequadamente investigados, com segurança, em ambulatório, ao passo que aqueles de alto risco necessitarão prontamente de uma monitorização, investigação e intervenção terapêutica em regime de internamento, com vista a modificar o seu prognóstico1,2.
Abordagem prática do diagnóstico diferencial da perda de conhecimento e síncope no contexto do Serviço de Urgência, com foco na estratificação de risco para síncope de causa cardíaca. †‐ apenas valorizável se história sugestiva de síncope arrítmica. AIT = Acidente Isquémico Transitório; AV = Bloqueio Auriculoventricular; DAVD = Displasia Arritmogénica do Ventrículo Direito; EAM = Enfarte Agudo do Miocárdio; FA = Fibrilhação auricular; FC = Frequência Cardíaca; IC = Insuficiência Cardíaca; TSV = Taquicardia Supraventricular; TV = Taquicardia Ventricular; SU = Serviço de Urgência.
A grande maioria dos doentes de alto risco, com critério de internamento, tem suspeita de síncope de causa cardíaca, que pode ser estrutural ou arrítmica. Nesta última etiologia, o registador de eventos implantável tem‐se tornado uma ferramenta diagnóstica fundamental em casos selecionados, nomeadamente em doentes com síncope de causa desconhecida. Os estudos publicados22–25 mostraram que o registador de eventos implantável permitiu aumentar o número de diagnósticos da causa de síncope comparativamente com o ECG de Holter ou o registador de eventos externo, teste de tilt e estudo eletrofisiológico. Apesar do registador de eventos implantável ser o modo de monitorização preferencial em ambulatório, as Recomendações europeias sugerem que também se pode optar pelo ECG de Holter ou pelo registador de eventos externo, caso os doentes tenham sintomas com periodicidade inferior a uma semana ou a um mês, respetivamente.
Abordagem terapêutica do doente com síncope reflexaTratamento não‐farmacológico inicialO primeiro passo na abordagem dos doentes com SVV consiste na sua educação, começando por explicar a natureza benigna desta condição e instruindo para a evicção de fatores precipitantes, tais como o ortostatismo prolongado, desidratação e temperaturas extremas, entre outros(10,2). As manobras de contrapressão isométrica, como o cerrar os punhos, o cruzar os membros inferiores ou o agachamento, induzem um aumento significativo da PA. Este efeito, sobretudo nos doentes com pródromos longos e capazes de reconhecer precocemente a sintomatologia de pré‐sincope, pode adiar ou mesmo prevenir a perda de consciência26–28. Um ensaio clínico multicêntrico mostrou que estas manobras, quando realizadas imediatamente após o início dos pródromos, resultaram numa redução do risco relativo de recorrência de síncope de 39%. No entanto, 35% dos doentes aleatorizados para a realização destas manobras não as utilizou por não apresentarem quadro prodrómico ou por este não ser suficientemente longo29. Em doentes idosos, com redução de força muscular, estas manobras poderão não ser tão eficazes. Ainda que exista apenas um estudo aleatorizado que testa o benefício das manobras de contrapressão, tendo em conta a sua inocuidade e a ausência de custo associado, tais manobras mantêm‐se como uma opção válida a considerar na estratégia terapêutica inicial destes doentes30 (indicação classe II‐A)22.
As medidas que aumentam o retorno venoso, como seja a expansão de volume com a ingestão de água (3L/dia) com a liberalização do consumo de sal (10g/dia), e o uso de meias elásticas de compressão graduada, desde que não estejam contra‐indicadas, podem ser usadas, ainda que a evidência sobre a sua eficácia seja limitada1,2,28. Por sua vez, o treino ortostático assenta essencialmente em dois métodos principais: (1) realização de sucessivos testes sob monitorização em mesa reclinável – teste de tilt; e (2) treino diário com manutenção de posição ortostática contra uma parede, em casa, durante um período prolongado30. Num ensaio clínico não‐aleatorizado, que incluiu 47 adolescentes, o treino ortostático com recurso a mesa reclinável mostrou ser eficaz na redução da recorrência da síncope, ao fim de 18 meses31. Ainda assim, por ser um método que exige um doente motivado, o cumprimento e a eficácia, a longo prazo, poderão estar frequentemente comprometidos32. Também persistem dúvidas sobre a sua eficácia pela ausência de demonstração de benefício na recorrência de síncope em vários outros estudos33–35. Em suma, a evidência existente até à data não é suficientemente robusta para apoiar a adoção, por rotina, destas medidas.
A neuroablação cardíaca é uma técnica que envolve ablação por radiofrequência de plexos ganglionares na superfície endocárdica. Em estudos não‐aleatorizado, com um número muito reduzido de doentes sintomáticos, foi sugerido um benefício no controlo da recorrência dos episódios sincopais36,37. Tal foi confirmado numa revisão da literatura recentemente publicada38. No entanto, a evidência atualmente existente é ainda escassa para corroborar a eficácia desta técnica36,37.
As estratégias psicoterapêuticas podem constituir uma componente útil na abordagem destes doentes, dada a ansiedade e o impacto psicossocial negativo muitas vezes associados à SVV recorrente. Estas poderão promover um sinergismo na resposta a outras terapêuticas concomitantes39.
Por fim, é fundamental uma revisão terapêutica cuidada da medicação habitual do doente. A redução posológica ou descontinuação terapêutica de fármacos potencialmente indutores dos episódios sincopais, tais como vasodilatadores e diuréticos, constituem uma medida importante na prevenção ou redução da probabilidade de eventos sincopais futuros22.
Tratamento farmacológicoAs estratégias farmacológicas podem ser consideradas nos doentes com episódios recorrentes, com impacto substancial na qualidade de vida e se associe a elevado risco de trauma ou a doentes com atividades de alto risco para o próprio ou para terceiros (condução profissional, pilotos, atletas de alta competição, entre outros)21, refratários às medidas não‐farmacológicas previamente discutidas. Têm sido investigados vários fármacos, com ação em diferentes pontos do arco reflexo previamente descrito, para tratamento da SVV28.
‐ Bloqueadores beta‐adrenérgicos (BB)Os BB são fármacos que atuam na porção aferente do arco reflexo da SVV. A sua eficácia foi testada em diversos ensaios clínicos aleatorizados, nomeadamente do metoprolol, pindolol e atenolol40–44. O maior ensaio clínico aleatorizado, controlado e de dupla ocultação realizado (estudo POST43) mostrou que o metoprolol não foi eficaz na prevenção da recorrência da síncope, ao fim de um ano de seguimento. Uma meta‐análise posterior, que inclui o estudo previamente referido, concluiu que a terapêutica BB poderá ter benefício nos doentes com ≥ 42 anos, quando comparado com os doentes com < 42 anos30. Os resultados de vários pequenos estudos que avaliaram diferentes BB e analisaram diversos outcomes (ex.: resultado do TT ou recorrência de episódios sincopais) apresentaram resultados díspares40,41,45–47. Na ausência de evidência robusta a favor dos BB, com dois ensaios clínicos aleatorizados com dupla‐ocultação com resultados negativos34–36, a par dos efeitos adversos conhecidos deste grupo farmacológico, as atuais recomendações contraindicam o seu uso na prevenção da SVV (recomendação classe III), independentemente da idade do doente em questão22. Ainda assim, aguardam‐se os resultados do ensaio clínico POST 5 (NCT02123056), aleatorizado e com tripla‐ocultação, que pretende determinar a eficácia do tratamento com metoprolol, em doentes ≥ 40 anos de idade, na redução da recorrência de episódios de síncope, em relação ao placebo.
‐ MidodrinaOs fármacos vasoconstritores contrariam a componente de vasodepressão, que na SVV surge em consequência da diminuição do tónus simpático. A midodrina, um agente alfa‐adrenérgico é frequentemente utilizada nestes casos. Numa meta‐análise, que incluiu 115 doentes de quatro estudos, a recorrência da síncope mostrou ser menor e a qualidade de vida superior durante o tratamento com midodrina quando comparada com terapêutica não‐farmacológica ou placebo48. Posteriormente, uma outra meta‐análise, incluindo 593 doentes, sugere que a midodrina melhora os outcomes clínicos em doentes com SVV recorrente, ainda que a evidência disponível seja de baixa/moderada qualidade49.
Aguardam‐se ainda os resultados do POST 4 (NCT01456481), um ensaio clínico aleatorizado e desenhado com o objetivo de avaliar a eficácia da midodrina comparativamente com placebo, na prevenção da recorrência dos episódios de síncope. Face à evidência atualmente disponível, a midodrina pode ser considerada em doentes com SVV e necessidade de terapêutica farmacológica1,2. As principais desvantagens do seu uso são uma semi‐vida curta, pelo que requer três administrações diárias, e os seus potenciais efeitos adversos, que incluem a retenção urinária e a hipertensão supina, o que limita o seu uso sobretudo nos doentes com idade avançada39.
‐ FludrocortisonaA fludrocortisona, um fármaco com efeitos mineralocorticóides, causa retenção hidrossalina e aumento modesto da PA. O estudo POST II, um ensaio clínico, aleatorizado, multicêntrico e controlado, comparou a eficácia da fludrocortisona com a do placebo. Incluiu 210 doentes com SVV recorrente, com o seguimento de um ano, tendo apenas demonstrado uma tendência estatística de benefício a favor da fludrocortisona. No entanto, quando os resultados foram analisados após um período de duas semanas de estabilização da dose, verificou‐se, uma redução significativa dos episódios de síncope entre os dois grupos. Deve ressalvar‐se que a idade média dos doentes incluídos foi de 30 anos e que os hipertensos foram excluídos50. Como tal, a fludrocortisona poderá estar reservada para os doentes com episódios de VSS repetidos e que não apresentem contra‐indicações para o seu uso, nomeadamente a hipertensão arterial. Os principais efeitos adversos são, além da hipertensão de decúbito e aumento de peso, as náuseas e a hipocaliemia30.
‐ Inibidores da recaptação de serotoninaOs inibidores da recaptação da serotonina (i.e., paroxetina, sertralina, fluoxetina) poderão eventualmente ter benefício na SVV, em doentes sem resposta ou intolerantes a outras terapêuticas19,45,51. Recentemente, um ensaio clinico aleatorizado e controlado com placebo, incluiu 106 doentes com episódios recorrentes de SVV, um score positivo na escala de ansiedade e sem diagnóstico de doença psiquiátrica, com um tempo de seguimento de um ano. O número de doentes com recorrência dos episódios de síncope e pré‐síncope foi inferior no grupo dos aleatorizados para fluoxetina45. Ainda assim, o benefício desta classe farmacológica permanece incerto e o seu uso não está recomendado, tendo em conta a escassez de evidência disponível30.
‐ IvabradinaNum ensaio clínico não‐aleatorizado e não‐controlado de 2014, no qual foram incluídos 25 doentes com Síndrome de Taquicardia Ortostática Postural, foi demonstrado algum potencial benefício com a ivabradina na redução de SVV52. Contudo, a evidência a favor desta terapêutica na redução do número de eventos de síncope, nos doentes com síndrome de taquicardia ortostática postural, é ainda desconhecida e de potencial futura investigação.
Abordagem interventiva com pacemaker na síncope reflexa vasovagal cardio‐inibitóriaAs recomendações europeias mais recentes apontam o PMD como uma terapêutica que deve ser considerada na síncope reflexa com mecanismo cardio‐inibitório (pausa assistólica > 3‐6 segundos), quer no síndrome de hipersensibilidade do seio carotídeo como na SVV, nomeadamente em doentes com > 40 anos com episódios sincopais recorrentes (recomendação classe II‐A)22. Esta atualização do grau de recomendação tem por base a revisão da evidência prévia disponível e alguns estudos recentemente publicados. No que diz respeito à SVV, há a ressalvar que os principais estudos apresentam heterogeneidade nos critérios de inclusão e exclusão, idade dos doentes incluídos, definição do componente cardio‐inibitório, caraterísticas da população e principais resultados. Os próximos parágrafos focam‐se na discussão comparativa e detalhada dos estudos com aleatorização (tabela 2).
Súmula da evidência oriunda de estudos que investigaram a intervenção com pacemaker comparativamente com o placebo, em doentes com SVV que aleatorizaram mais do que 20 doentes
| Identificação do Estudo | VPS‐I53, Connolly1998 | VASIS‐PM10, Sutton 2000 | VPS‐II58, Connolly 2003 | SYNPACE59, Raviele 2004 | ISSUE‐355, Brignole 2012 | Russo et al56. 2013 | SPAIN57, Baron‐Esquivias 2017 |
|---|---|---|---|---|---|---|---|
| Desenho de Estudo | |||||||
| Centro(s) | Multicêntrico | Multicêntrico | Multicêntrico | Multicêntrico | Multicêntrico | Multicêntrico | Multicêntrico |
| Desenho | Prospetivo e Aleatorizado | Prospetivo e Aleatorizado | Prospetivo e Aleatorizado | Prospetivo e Aleatorizado | Prospetivo e Aleatorizado; Cruzamento aos 12M | Prospetivo e Aleatorizado; Cruzamento aos 18M | Prospetivo e Aleatorizado |
| Ocultação | Não | Não | Dupla | Dupla | Dupla | Simples | Dupla |
| Número de doentes (n) | 54 | 42 | 100 | 29 | 77 | 50 | 46 |
| Braço PMD vs Braço Placebo | 27 vs 27 | 19 vs 23 | 48 vs 52 | 16 vs 13 | 38 vs 39 | S/I | 21 vs 25 |
| Braço Placebo | Sem intervenção | Sem intervenção | PMD OFF | PMD OFF | PMD OFF | PMD OFF | Sham PMD |
| Tempo de Seguimento médio | S/I | 3,76 ± 2,2A | 6M | 715 (302–785) dias | 24M | 36M | 22,2 ± 5,1M |
| Critérios de Inclusão | |||||||
| Tipo de Síncope | Vasovagal | Vasovagal | Vasovagal | Vasovagal | Vasovagal | Vasovagal | Vasovagal |
| Número total de síncopes | ≥6 | ≥ 3 há ≤ 2A | ≥ 6 ou ≥ 3 há ≤ 2A | ≥6 | ≥ 3 há ≤ 2A | ≥2 | ≥ 5 |
| Último episódio de síncope | ‐ | < 6M | ‐ | < 6M | ‐ | ‐ | ≥ 2 há ≤ 12M |
| Intervalo entre primeiro e último episódio de síncope | ‐ | > 6M | ‐ | ‐ | ≥1M | ‐ | ‐ |
| Critérios de Cardio‐inibição com reprodução de síncope | FC < 60 bpm ou < 70 bpm se 2 mcg/min ou < 80 bpm se > 2 mcg/min de isoproterenol EV | FC < 40 BPM durante > 10 segundos ou assistolia > 3 segundos com queda da PA | FC x PA < 6000 | FC< 60 bpm durante > 10 segundos ou assistolia ≥ 3 segundos | Assistolia > 3 segundos com síncope ou > 6 segundos com pré‐síncope ou assintomático | Assistolia > 3 segundos com queda da PA | FC< 40 bpm durante > 10 segundos ou assistolia > 3 segundos com queda da PA |
| Método de deteção da Cardio‐inibição | TT | TT | TT | TT | REI | TT | TT |
| Tipo de Intervenção | PMD vs Placebo | PMD vs Placebo | PMD ONvs PMD OFF | PMD ONvs PMD OFF | PMD ONvs PMD OFF | PMD ONvs PMD OFF | PMD vssham DDI |
| Programação do PMD | DDI‐RDR | DDI‐RDR | DDD‐RDR | DDD‐RDR | DDD‐RDR | DDD‐CLS | DDD‐CLS |
| Outros | ‐ | > 40A ou < 40A se refratariedade farmacológica | > 19A | > 18A e ≥ 1 síncope até ≤ 12M após TT | > 40A, refratariedade terapêutica | > 40A, RS | > 40A com ECG normal |
| Critérios de Exclusão | |||||||
| Síncope Vasodepressora pura | Excluídos | Excluídos | Incluídos§ | Excluídos | Excluídos | Excluídos | Excluídos |
| Outros critérios chave | Doença crónica grave, HSC, valvulopatia importante | EAM < 6M, IC (NYHA III‐IV), doença crónica grave | ECG anormal, doença crónica grave | EAM < 6M, IC (NYHA III‐IV), doença crónica grave, HSC | HSC, IC de novo, FEVE ≤ 40%, EAM | HTA, DM, IC, anemia, DAC | HSC |
| Características da População (PMD) | |||||||
| Idade média | 46 ± 18A | 64 ± 11A* | 50 ± 18 | 52 ± 19A | 63 ± 14A | 53 ± 5A | 57 ± 13A |
| Homens | 30% | 58% | 27%* | 31% | 53% | 66% | 48% |
| Média de episódios de síncope prévios | 14 (8‐35) | 5 (3‐12) | 15 (8‐50) | 14 (9‐30) | 7 (4‐12) | 7 ± 3 | 12 (9‐20) |
| Pré‐Síncope | S/I | 63% | 71% | 3 (0‐10) | 50% | S/I | S/I |
| Assistolia > 3 segundos | 0% | 86% | 0% | 52% | 100% | 100% | 76% |
| História de Trauma | S/I | 42% | 13% | 25% (major) | 5% (major)39% (minor) | 8% | S/I |
| Outcomes | |||||||
| Recorrência de Síncope (PMD vs Placebo) | 22% vs 70%* | 5% vs 61%* | 31% vs 40% | 50% vs 38% | 25% vs 57%* | 2 vs 15* | 8,7% vs 45,7%* |
A= anos; bpm = batimentos por minuto; CLS = Closed‐Loop Stimulation; DAC = Doença Arterial Coronária; DM = Diabetes mellitus; EAM = Enfarte Agudo do Miocárdio; ECG = Eletrocardiograma; EV = Endovenoso; FC = Frequência Cardíaca; FEVE = Fração de Ejeção Ventricular Esquerda; HSC = Hipersensibilidade do Seio Carotídeo; HTA = Hipertensão Arterial; IC = Insuficiência Cardíaca; M = meses; NYHA = New York Heart Association; N/S = Não‐Significativo; PA = Pressão Arterial; PMD = Pacemaker Definitivo; RDR = Rate Drop Response; REI = Registador de Eventos Implantável; RS = Ritmo Sinusal; S/I = sem informação; TT = Teste de tilt. * = Diferença estatisticamente significativa comparativamente com o grupo placebo (p < 0,05); § ‐ com base nos critérios de cardio‐inibição e vasodepressão do estudo VASIS.
A avaliação do potencial do PMD na redução de recorrência de síncope foi inicialmente efetuada em estudos com uma menor robustez de evidência pelo seu desenho de estudo. Entre estes, os estudos aleatorizados sem ocultação da alocação VPS I, VASIS e SYDIT serão discutidos adiante. O estudo VPS I (n = 54) foi o primeiro com um desenho aleatorizado que investigou o papel do PMD na SVV com pré‐síncope ou síncope reprodutível no TT com demonstração de bradicardia relativa. Neste estudo, os doentes que receberam um PMD com algoritmo Rate Drop Response (RDR) tiveram uma redução estatisticamente significativa do risco de síncope comparativamente com o braço placebo [22% versus 70%; Redução do Risco Relativo (RRR): 0,85; 95% IC: 0,60‐0,95; 2p = 0,000022], ao longo de 12 meses de seguimento53.
O estudo VASIS (n = 42) mostrou uma redução estatisticamente significativa da recorrência de síncope no braço que recebeu PMD‐DDI comparativamente com o placebo [5% versus 61%; Risco Relativo (RR): 0,04; 95% Intervalo de Confiança (IC): 0,005‐0,3; p = 0,0006], em doentes com SVV com uma componente cardio‐inibitória, ao longo de um seguimento médio de 3,76 ± 2,2 anos. Há a ressalvar que a síncope recorreu em 70% dos doentes que não receberam PMD, com uma média de 1,76 ± 0,9 episódios por doente (0,44 episódios por ano). Não só a recorrência foi pouco frequente como nenhum dos episódios de síncope se associou a lesão traumática10.
O estudo prospetivo e multicêntrico SYDIT incluiu doentes com idade > 35 anos, SVV recorrente (≥ 3 episódios nos últimos dois anos) e um TT positivo para síncope com concomitante bradicardia relativa (FC < 60 bpm). Os doentes foram aleatorizados para receber PMD‐DDD‐RDR (n = 47) ou atenolol 50‐100mg/dia (n = 46) e avaliados durante um seguimento médio de 520 ± 266 dias. A resposta ao TT foi positiva apenas na fase de provocação farmacológica em 56% dos doentes e uma resposta cardio‐inibitória pura (assistolia > 3 segundos) só foi detetada em 60,2% dos doentes. Ainda que se trate de um estudo sem um verdadeiro braço placebo e com as respetivas limitações inerentes a este tipo de desenho, houve uma redução da recorrência de síncope nos doentes que recebem PMD comparativamente com a intervenção farmacológica [4,3% versus 25,5%, Odds Ratio (OR): 0,133; 95% IC: 0,028‐0,632; p = 0,004]. Como tal, os autores concluíram que, numa população com idade média > 50 anos e uma carga elevada de episódios sincopais com componente cardio‐inibitória, o PMD‐DDR foi superior à estratégia farmacológica na redução do número de eventos sincopais54.
Estudos aleatorizados com ocultação da aleatorizaçãoOs estudos aleatorizados sem ocultação indicam que o PMD poderá constituir uma intervenção com benefício em doentes selecionados. Contudo, este tipo de desenho de estudo apresenta limitações importantes e maior probabilidade de viés. Como tal, a investigação prosseguiu com recurso a estudos aleatorizados com ocultação, os quais mostraram resultados díspares, alguns dos quais favorecendo o uso de PMD (ISSUE‐3, Russo et al., SPAIN), ao passo que outros não evidenciaram benefício desta intervenção (SYNPACE, VPS II).
O estudo ISSUE‐3 (n = 77) mostrou uma redução estatisticamente significativa da recorrência de SVV cardio‐inibitória em doentes com idade ≥ 40 anos e assistolia prolongada (> 3‐6 segundos) que receberam um PMD‐DDD ON comparativamente com o grupo PMD OFF (25% versus 57%; RR: 0,57; 95% IC: 0,40‐0,74; p = 0,04), ao longo de dois anos de seguimento. Ainda que se tenha demonstrado eficácia nesta subpopulação de doentes com síncope, há a destacar uma recorrência de 25% de síncope no grupo com PMD ON, superior aos estudos supracitados. Os autores atribuem estes eventos a uma provável componente vasodepressora que contribui para o mecanismo de alguns dos episódios sincopais55.
O estudo de Russo et al. (n = 50) incluiu somente doentes com síncope de causa cardio‐inibitória com assistolia > 3 segundos, os quais foram aleatorizados para PMD‐DDR com algoritmo Closed‐Loop Stimulation (CLS) ou PMD OFF. Os doentes a receber tratamento ativo tiveram uma redução do número de episódios sincopais, comparativamente com os doentes sem tratamento ativo (2 versus 15 episódios; p = 0,007), ao longo de 36 meses de seguimento56.
Recentemente, o estudo SPAIN (n = 46) mostrou um benefício da intervenção PMD DDD‐CLS comparativamente com sham PMD‐DDI, com uma redução em ≥ 50% dos eventos, significativamente superior no primeiro grupo comparativamente com o segundo (72% versus 28%; p = 0,017). Ao longo do primeiro ano do estudo, os eventos sincopais foram menos frequentes nos doentes do grupo de intervenção comparativamente com o grupo sham [8,7% versus 45., %; Hazard Ratio (HR): 6,7; 95% IC: 2,3‐19.8] ao longo de um seguimento médio de 22,2 ± 5,1 meses. No segundo ano do estudo, em que se procedeu a um cruzamento dos grupos, foi evidenciada uma recorrência de síncope em 29% dos doentes que previamente tinham recebido DDD‐CLS, concomitantemente como uma redução em > 50% dos eventos sincopais em todos os doentes que previamente tinha recebido o sham PMD‐DDI (p = 0,0003), achados estes que aumentam a força de evidência desta intervenção57.
Pelo contrário, no estudo VPS II (n = 100) os doentes que receberam terapêutica com DDD‐RDR não tiveram redução do risco cumulativo de episódios sincopais comparativamente com o grupo PMD OFF (31% versus 40%; RRR: 0,30; 95% IC: ‐0,33‐0,63; p = 0,14) ao longo de seis meses de seguimento58. Do mesmo modo, o estudo SYNPACE (n = 29) não mostrou diferenças estatisticamente significativas nos outcomes estudados ao fim 23,8 meses de média de seguimento quando se comparou o grupo que recebeu PMD‐DDD‐RDR com o grupo PMD OFF, inclusive na análise de subgrupos (síncope cardio‐inibitória e síncope mista). Neste estudo, a componente cardio‐inibitória foi definido como síncope reprodutível com TT concomitantemente com assistolia de três segundos ou superior ou uma FC < 60 bpm. Há a ressalvar que o TT foi positivo em 69% dos doentes apenas após administração de nitroglicerina. A assistolia foi detetada em 52% e uma resposta mista em 48% dos doentes59.
Os resultados aparentemente discrepantes entre os estudos previamente discutidos têm sido ativamente debatidos e poderão estar relacionados com as seguintes problemáticas: (1) heterogeneidade nos critérios de inclusão da população; (2) diferenças nos desenhos dos estudos; (3) diferentes programações do PMD no braço de intervenção; ou (4) uma verdadeira ausência de benefício da intervenção com PMD no doente com SVV. Antes de mais, os estudos positivos incluíram uma população tendencialmente mais idosa, o que levanta uma questão relativamente aos diferentes mecanismos fisiopatológicos da SVV consoante a faixa etária. No estudo SYNPACE, os critérios para síncope mista foram relativamente mais alargados, abrangendo doentes com FC < 60 bpm (ao invés de < 40 bpm) durante > 10 segundos no período sincopal foram também incluídos, representando 48% dos doentes elegíveis para o estudo. Tais critérios poderão ter levado a uma inclusão de doentes com uma componente vasodepressora predominante como mecanismo fisiopatológico do seu episódio sincopal. Do mesmo modo, no estudo VPS II foram incluídos doentes com uma componente vasodepressora predominante, uma vez que a média de FC regista mais baixa foi de 53 bpm e apenas 19% dos doentes apresentaram FC < 40 bpm, contrastando com os critérios de inclusão nos estudos positivos, mais restritivos relativamente à componente cardio‐inibitória.
O valor diagnóstico do TT para uma deteção precisa de componente cardio‐inibitória como causa do episódio sincopal tem sido questionado60. A evidência atual indica que a presença de uma resposta cardio‐inibitória durante o TT prevê, com alta probabilidade, a síncope por assistolia e, com base nestes achados, as atuais Recomendações europeias consideram o TT como fundamental no algoritmo diagnóstico de assistolia para potencial decisão de colocação de PMD, sobretudo em doentes com idade > 40 anos e síncope recorrente cardio‐inibitória22.
Os dados descritos numa meta‐análise que avaliou o uso do PMD na recorrência da síncope reflexa sugerem que a evidência do seu uso é limitada nesta entidade clínica61. Ainda que a análise dos estudos sem dupla ocultação aponte para uma menor incidência de síncope com o uso de PMD, os únicos dois estudos aleatorizados e de dupla ocultação incluídos (SYNPACE e ISSUE‐3) não demonstraram benefício estatisticamente significativo neste outcome. Os autores referem que tal discrepância pode ser o resultado do viés dos estudos sem ocultação61. Ainda assim, seria interessante proceder a uma atualização desta revisão sistemática com a inclusão do recentemente publicado estudo SPAIN, uma vez que este cumpre todos os critérios de inclusão considerados pelos autores e poderá modificar os resultados previamente mencionados.
Em suma, tendo em conta que a síncope reflexa é uma condição sem impacto na mortalidade, frequentemente observada numa população jovem, em adição aos riscos inerentes à colocação de um PMD e à evidência controversa para suportar o seu uso, torna‐se fundamental selecionar cuidadosamente os doentes que poderão ter o maior benefício desta intervenção. A estratégia de decisão deverá incluir a avaliação da recorrência dos episódios, o mecanismo fisiopatológico subjacente e o impacto na qualidade de vida do doente, de acordo com a resposta às medidas terapêuticas implementadas (nomeadamente, manobras de contrapressão), considerando‐se terapêutica com PMD em adultos com > 40 anos de idade adequadamente selecionados, com base na recorrência dos episódios e na deteção de mecanismo cardio‐inibitório.
O PMD com um algoritmo DDD‐CLS permite detetar alterações na dinâmica inotrópica ventricular direita através da medição de impedância intracardíaca. A deteção desta alteração numa fase inicial prévia ao episódio sincopal permite uma resposta precoce do PMD, consequentemente impedindo este evento. O benefício desta programação foi sugerido inicialmente em pequenos estudos observacionais62,63. O estudo INVASY (n = 50), com um desenho prospetivo de ocultação simples que incluiu doentes com síncope recorrente com uma componente cardio‐inibitória no TT e refratária a terapêutica convencional, mostrou não haver qualquer recorrência de episódios sincopais nos doentes que receberam DDD‐CLS comparativamente com DDI64. Recentemente, os estudos prospetivos aleatorizados de Russo et al56. e o SPAIN57, já previamente descritos, vieram reforçar a evidência a favor desta programação.
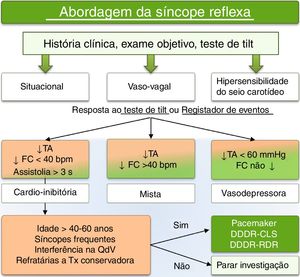
Algoritmo de decisão terapêuticaA evidência atual não favorece o uso de PMD, por rotina, no doente com SVV. Contudo, esta aponta para um papel do PMD com RDR ou CLS no subgrupo de doentes com uma elevada recorrência de síncope, com uma componente cardio‐inibitória, sobretudo naqueles com > 40‐50 anos de idade e refratariedade a outras terapêuticas. Assim, de modo a promover um racional para o uso de PMD com base na evidência atual, reduzir a potencial sobre‐utilização em doentes com menor benefício e evitar a subutilização em potenciais beneficiários desta intervenção, apresenta‐se um algoritmo de decisão (fig. 4) que poderá ser útil na seleção destes doentes. O algoritmo proposto está de acordo com as Recomendações europeias recentemente publicadas (ESC 2018)22. Estas introduzem a ideia inédita de que o tratamento da recorrência da síncope se correlaciona melhor com a forma de apresentação da síncope reflexa (bradicardia e/ou hipotensão) do que com a sua etiologia. Este conceito está de acordo com a evidência do benefício do PMD somente em determinadas entidades clínicas, nomeadamente na síncope de causa cardíaca por bradidisritmia significativa, síndrome de hipersensibilidade do seio carotídeo cardio‐inibitória e SVV cardio‐inibitória. De acordo com este racional e com os estudos ISSUE‐3 e SPAIN, atualmente considera‐se uma recomendação classe II‐A no grupo de doentes com SVV recorrente cardio‐inibitória e uma idade ≥ 40 anos22.
ConclusãoA abordagem terapêutica do doente com SVV permanece um desafio na atualidade, nomeadamente no doente com compromisso da qualidade de vida por recorrência dos episódios sincopais e fraca resposta a medidas terapêuticas gerais ou farmacológicas. O PMD pode constituir uma opção interventiva em doentes adequadamente selecionados, que se apresentem com síncope reflexa predominantemente cardio‐inibitória, associada a elevada recorrência dos episódios sincopais e importante impacto na qualidade de vida, nomeadamente perante uma história de trauma maior associado e quando se esgotam outras opções terapêuticas.
Declaração éticaOs autores do artigo ABORDAGEM DIAGNÓSTICA E TERAPÊUTICA DA SÍNCOPE REFLEXA CARDIO‐INIBITÓRIA – A COMPLEXIDADE DE UM TEMA CONTROVERSO
Declaram
Proteção de seres humanos e de animais: Os autores declaram que não foram efetuadas quaisquer experimentações em seres humanos ou em animais neste estudo.
Confidencialidade dos dados: Os autores declaram que não é referenciada qualquer informação confidencial de doentes neste estudo.
Direito à privacidade e consentimento informado: Os autores declaram que não é referenciada qualquer informação confidencial de doentes neste estudo.
FinanciamentoNenhum a declarar.
Conflitos de InteressesNenhum a declarar.