Avaliar o impacto da estratégia conservadora no enfarte agudo do miocárdio sem supradesnivelamento de ST nos doentes do Registo Nacional de Síndromes Coronárias Agudas.
MétodosDos 3780 doentes incluídos no estudo durante um período de três anos, foram formados três grupos: no grupo 1 foram incluídos os submetidos a estratégia conservadora; no grupo 2 foram incluídos os doentes submetidos a coronariografia sem realização de intervenção coronária percutânea e no grupo 3 os que foram submetidos a intervenção coronária percutânea. Compararam‐se as características clínicas e de procedimento e as complicações ocorridas no internamento. O endpoint primário foi definido pela mortalidade intra‐hospitalar ou morte ao fim de um ano e o endpoint secundário foi definido pela ocorrência de pelo menos uma das seguintes complicações: hemorragia grave definida pelos critérios de GUSTO, necessidade de transfusão, ventilação invasiva, insuficiência cardíaca e reenfarte.
ResultadosDos doentes analisados, 16,5% foram submetidos a estratégia conservadora; estes eram mais velhos, mais frequentemente mulheres e apresentavam mais fatores de alto risco. A estratégia conservadora associou‐se a maior atingimento do endpoint primário − mortalidade intra‐hospitalar (10,6% versus 1,1% versus 0,6%, p<0,001, odds‐ratio [OR] de 6,974, intervalo de confiança a 95% [IC95%]: 2,775‐17,527), mortalidade ao ano (26,1% versus 6,8% versus 4,1%, p<0,001, hazard‐ratio (HR) 2,925, IC95%: 1,433‐5,974) − e do endpoint secundário − 37,2% versus 18,9% versus 14,6%, p<0,001; OR 1,471 IC95%: 1,043‐2,076.
ConclusõesNeste conjunto de doentes, a estratégia conservadora é um preditor independente de mortalidade intra‐hospitalar, complicações intra‐hospitalares e da mortalidade ao ano.
The aim of this study was to assess the impact of a conservative strategy in non‐ST‐segment elevation myocardial infarction in patients in the Portuguese Registry of Acute Coronary Syndromes.
MethodsThe 3780 patients included in the study over a three‐year period were divided into three groups: group 1, patients treated by a conservative strategy during hospitalization; group 2, patients who underwent coronary angiography without percutaneous coronary intervention (PCI); and group 3, patients who underwent PCI. Clinical and procedural data and in‐hospital complications were compared. The primary endpoint was defined as in‐hospital or one‐year mortality and the secondary endpoint as the presence of at least one of the following in‐hospital complications: major bleeding according to the GUSTO criteria, need for blood transfusion, invasive ventilation, heart failure or reinfarction.
ResultsOf the patients analyzed, 16.5% were treated by a conservative strategy. Patients in this group were older, more often women, and had more high‐risk factors. A conservative strategy was associated with a higher rate of the primary endpoint – in‐hospital mortality (10.6% vs. 1.1% vs. 0.6% in groups 1, 2 and 3, respectively, p<0.001, odds ratio (OR) 6.974, 95% confidence interval [CI]: 2.775‐17.527) and one‐year mortality (26.1% vs. 6.8% vs. 4.1%, p<0.001, hazard ratio (HR) 2.925, 95% CI: 1.433 ‐5.974) ‐ and of the secondary endpoint − 37.2% vs. 18.9% vs. 14.6%, p<0.001; OR 1.471 95% CI: 1.043 ‐2.076.
ConclusionsIn this patient population, a conservative strategy is an independent predictor of in‐hospital mortality, in‐hospital complications and one‐year mortality.
A revascularização no enfarte agudo do miocárdio sem supradesnivelamento de ST (EAMSST) permite o alívio de sintomas, diminui o tempo de internamento e melhora o prognóstico1–3. No entanto, as indicações e o timing para revascularização miocárdica dependem de vários fatores, alguns intrínsecos ao doente − como a idade, o género e as comorbilidades – e outros extrínsecos, como a disponibilidade de meios. Por conseguinte e apesar da estratégia invasiva combinada com terapêutica médica otimizada se encontrar associada a aumento da sobrevida em todas as idades4, sabe‐se que a abordagem terapêutica é mais seletiva nos indivíduos mais velhos na qual a presença de comorbilidades é reconhecida como uma limitação à realização de coronariografia1,5. Relativamente às desigualdades de género, vários estudos mostram que as mulheres são menos submetidas a coronariografia do que os homens6, apesar de o benefício similar7. Por outro lado, os dados do registo Global Registry of Acute Coronary Events (GRACE), o maior registo multinacional de doentes com síndrome coronária aguda (SCA) – mostram que existe uma relação inversa entre o risco do doente e a realização de coronariografia8. Estes factos mostram a complexidade da análise dos fatores que determinam a estratégia terapêutica dado que a decisão de realização de coronariografia depende dos meios existentes, dos protocolos intra‐hospitalares e principalmente da decisão médica individual.
O objetivo deste trabalho é descrever e estudar o impacto da estratégia conservadora na abordagem das SCA, na fase hospitalar e no médio prazo.
População e métodosDas bases de dados do Registo Nacional de Síndromes Coronárias Agudas (RNSCA) e da Sociedade Portuguesa de Cardiologia considerou‐se, no período compreendido entre 1 de outubro de 2010 e 1 de outubro de 2013, uma população de 3799 doentes com EAMSST, definido pela elevação de marcadores de lesão miocárdica−troponina ou isoenzima MB da creatina quinase (CK‐MB)−em contexto de sintomatologia compatível com isquemia miocárdica e sem elevação persistente (<30 minutos) do segmento ST no eletrocardiograma (ECG) de 12 derivações considerado para o diagnóstico. Consideraram‐se os doentes com informação sobre realização de coronariografia e/ou realização de intervenção coronária percutânea (ICP) (n=3780). Definiu‐se estratégia conservadora pela não realização de coronariografia e estratégia invasiva pela realização de coronariografia durante o internamento, que poderia ser seguida ou não de realização de ICP. Definiu‐se a gravidade das lesões coronárias como não significativas se estenose<50%, significativas estenose ≥50% e<100% e oclusão com estenose de 100%. Definiu‐se vaso tratado por ICP pelos critérios do RNSCA, isto é, por lesão residual inferior a 30% e fluxo TIMI 3 no final da angioplastia. Procedeu‐se à distribuição em três grupos: o grupo 1 incluiu os doentes submetidos a estratégia conservadora (n=623), o grupo 2 incluiu os doentes submetidos a coronariografia mas não submetidos a ICP (n=1229) e o grupo 3 incluiu os doentes submetidos a coronariografia e a ICP (n=1928). Compararam‐se os grupos com base em critérios clínicos e relacionados com o procedimento e complicações intra‐hospitalares (CIH), nomeadamente: (1) reenfarte, definido no RNSCA por recorrência de dor torácica sugestiva de isquemia, após resolução do episódio da dor de admissão, com duração superior a 20 minutos, acompanhada de alterações eletrocardiográficas e de nova elevação dos biomarcadores de lesão miocárdica em relação ao valor prévio (elevação de CK‐MB duas vezes o valor de referência ou >50% do valor prévio; ou elevação de >20% do valor da troponina I ou da troponina T em relação ao valor prévio); (2) insuficiência cardíaca (IC); (3) complicação mecânica definida por rutura da parede livre do miocárdio ou rutura do septo interventricular ou insuficiência mitral aguda grave por envolvimento dos músculos papilares; (4) fibrilhação auricular (FA) de novo, definida pela presença de forma paroxística ou persistente, de FA que não existia previamente ao internamento; (5) bloqueio auriculoventricular (BAV) de 2.° grau Mobitz 2 ou graus mais avançados; (6) taquicardia ventricular (TV) mantida – definida pela presença, durante o internamento hospitalar, de TV monomórfica ou polimórfica com duração superior a 30 segundos ou associada a instabilidade hemodinâmica; (7) paragem cardíaca ressuscitada – ocorrência de paragem cardíaca durante o internamento hospitalar, ressuscitada com êxito, independentemente da causa; (8) acidente vascular cerebral (AVC) isquémico ou AVC hemorrágico; (9) hemorragia major – definida pela ocorrência durante o internamento hospitalar de hemorragia intracraniana ou hemorragia com compromisso hemodinâmico requerendo intervenção de acordo com a classificação de GUSTO9 ou necessidade de transfusão com concentrado de eritrócitos. Foi determinado o destino após alta hospitalar e foi realizado seguimento clínico num período de até um ano após alta hospitalar.
O endpoint primário foi definido pela mortalidade intra‐hospitalar (MIH) ou pela mortalidade ao fim de um ano (M1ano), por qualquer causa. O endpoint secundário foi definido pela presença de pelo menos uma das seguintes CIH durante o internamento: hemorragia major ou necessidade de transfusão com concentrado de eritrócitos, ou necessidade de ventilação mecânica invasiva – se utilizado tubo traqueal, máscara laríngea ou traqueostomia como interface ventilador‐doente−ou IC congestiva ou reenfarte.
Na análise estatística, as variáveis categóricas foram caracterizadas por intermédio de frequências absolutas e frequências relativas; as diferenças das proporções entre os grupos foram avaliadas recorrendo ao teste qui‐quadrado assintótico e ao teste qui‐quadrado com método de Monte Carlo, quando os pressupostos de utilização do primeiro não foram satisfeitos. As variáveis contínuas foram caracterizadas recorrendo à média, desvio padrão, quartis, mínimo e máximo. A ANOVA foi usada para comparar médias dos grupos; quando os pressupostos desta não foram satisfeitos, considerou‐se o teste Kruskal‐Wallis para comparar a distribuição dos valores das variáveis contínuas. A normalidade da distribuição dos valores das variáveis contínuas e a igualdade das suas variâncias foram testadas através do teste Kolmogorov‐Smirnov e do teste de Levene, respetivamente. Foram construídos dois modelos de regressão logística, um para a MIH e outro para as CIH, de forma a averiguar se a não realização de estratégia invasiva é um preditor de mau prognóstico. Considerou‐se o método stepwise forward para a seleção das variáveis a incluir no modelo final; os valores p considerados na remoção e na inclusão das variáveis no modelo foram de 0,10 e 0,05, respetivamente. O efeito da variável definidora dos três grupos na ocorrência de cada um dos endpoints foi ajustado pela inclusão dos seguintes potenciais confundidores: género, idade, índice de massa corporal (IMC), antecedentes patológicos e fatores de risco cardiovascular (FRCV), dados do exame físico na admissão, parâmetros laboratoriais, medicação prévia ao evento, medicação administrada no internamento e a avaliação da fração de ejeção ventricular esquerda (FEVE). No caso da MIH foram ainda consideradas as CIH. A calibração dos modelos foi testada por intermédio do teste Hosmer‐Lemeshow e considerou‐se a medida c‐statistic para avaliar as suas capacidades discriminatórias. O risco de ocorrência de cada um dos endpoints associado a cada preditor foi estimado por intermédio do odds ratio e do respetivo intervalo de confiança a 95% (IC95%). A avaliação do efeito da estratégia terapêutica na M1ano foi avaliada a partir da construção de um modelo de regressão de Cox. Também aqui se considerou o método de seleção stepwise forward com valores p de 0,10 e 0,05, para remoção e inclusão, respetivamente. Consideraram‐se os mesmos potenciais confundidores utilizados para a MIH e, adicionalmente, a medicação na alta. O risco de M1ano, associado a cada preditor, foi estimado por intermédio do hazard ratio e do respetivo IC95%. Finalmente, procedeu‐se à estratificação do risco dos doentes de acordo com os seguintes tercis do score GRACE2: risco baixo (≤108), risco intermédio (109‐140) e risco alto (>140).
Foi utilizado o software IBM® SPSS® Statistics (versão 19.0.0.2) para a realização de toda a análise estatística. Os testes foram realizados ao nível de significância de 5%.
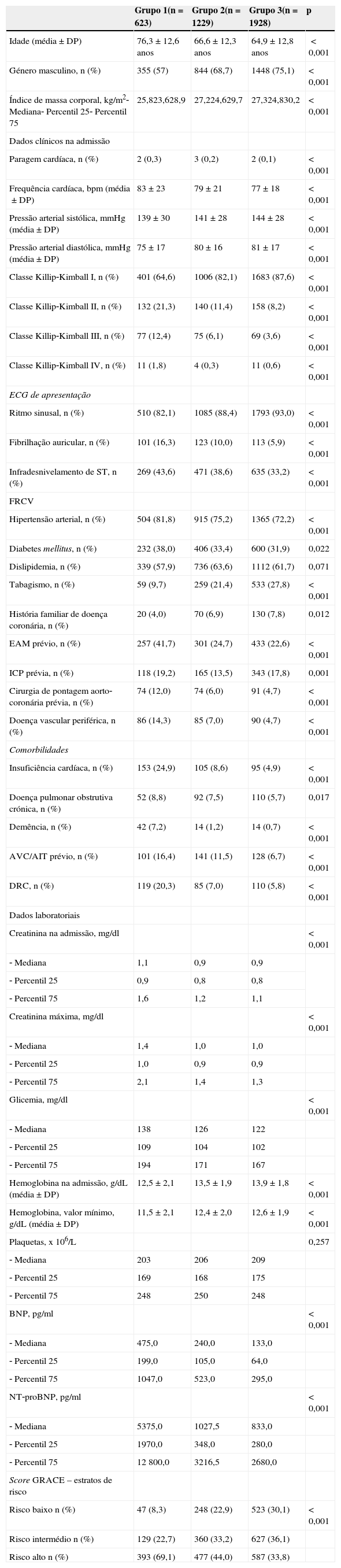
ResultadosCaracterização da populaçãoA distribuição da população pelos grupos foi a seguinte: grupo 1 – 16,5%; grupo 2 – 32,5%; grupo 3 – 51,0%. As características gerais encontram‐se na Tabela 1. Constata‐se a maior prevalência do género masculino em todos os grupos e a sua maior prevalência nos grupos submetidos a estratégia invasiva. Os doentes do grupo 1 são mais velhos, têm maior prevalência de FRCV, de doença coronária identificada−e de procedimentos de revascularização miocárdica – de doença vascular periférica e de comorbilidades como IC, doença pulmonar obstrutiva crónica, demência, doença cerebrovascular e doença renal crónica (DRC) – definida no RNSCA como creatininemia prévia ao internamento >2,0mg/dl ou realização de diálise ou antecedentes de transplante renal. Nos parâmetros laboratoriais, destacam‐se os valores mais elevados de creatinina na admissão e creatinina máxima – em concordância com a maior prevalência de DRC – bem como valores mais baixos de hemoglobina e valores mais elevados de brain natriuretic peptide (BNP) e da porção N‐terminal do BNP (NT‐pro‐BNP) no grupo 1. Na admissão hospitalar os doentes submetidos a estratégia conservadora têm maior prevalência de IC com classe de Killip‐Kimball >I, de FA e de infradesnivelamento do segmento ST – definido pelo infradesnivelamento de ST horizontal ou em rampa descendente, superior a 0,5mm (0,05mV) em duas ou mais derivações contíguas. Por último, constata‐se a maior percentagem de doentes no estrato de alto risco do score GRACE no grupo da estratégia conservadora, com diferença significativa; por outro lado, o grupo dos doentes submetidos a coronariografia e ICP apresenta as maiores percentagens de doentes nos estratos de risco baixo e risco intermédio e menor percentagem de doentes no estrato de risco elevado.
Caracterização da população – variáveis clínicas, laboratoriais e score GRACE
| Grupo 1(n=623) | Grupo 2(n=1229) | Grupo 3(n=1928) | p | |
|---|---|---|---|---|
| Idade (média±DP) | 76,3±12,6 anos | 66,6±12,3 anos | 64,9±12,8 anos | <0,001 |
| Género masculino, n (%) | 355 (57) | 844 (68,7) | 1448 (75,1) | <0,001 |
| Índice de massa corporal, kg/m2‐ Mediana‐ Percentil 25‐ Percentil 75 | 25,823,628,9 | 27,224,629,7 | 27,324,830,2 | <0,001 |
| Dados clínicos na admissão | ||||
| Paragem cardíaca, n (%) | 2 (0,3) | 3 (0,2) | 2 (0,1) | <0,001 |
| Frequência cardíaca, bpm (média±DP) | 83±23 | 79±21 | 77±18 | <0,001 |
| Pressão arterial sistólica, mmHg (média±DP) | 139±30 | 141±28 | 144±28 | <0,001 |
| Pressão arterial diastólica, mmHg (média±DP) | 75±17 | 80±16 | 81±17 | <0,001 |
| Classe Killip‐Kimball I, n (%) | 401 (64,6) | 1006 (82,1) | 1683 (87,6) | <0,001 |
| Classe Killip‐Kimball II, n (%) | 132 (21,3) | 140 (11,4) | 158 (8,2) | <0,001 |
| Classe Killip‐Kimball III, n (%) | 77 (12,4) | 75 (6,1) | 69 (3,6) | <0,001 |
| Classe Killip‐Kimball IV, n (%) | 11 (1,8) | 4 (0,3) | 11 (0,6) | <0,001 |
| ECG de apresentação | ||||
| Ritmo sinusal, n (%) | 510 (82,1) | 1085 (88,4) | 1793 (93,0) | <0,001 |
| Fibrilhação auricular, n (%) | 101 (16,3) | 123 (10,0) | 113 (5,9) | <0,001 |
| Infradesnivelamento de ST, n (%) | 269 (43,6) | 471 (38,6) | 635 (33,2) | <0,001 |
| FRCV | ||||
| Hipertensão arterial, n (%) | 504 (81,8) | 915 (75,2) | 1365 (72,2) | <0,001 |
| Diabetes mellitus, n (%) | 232 (38,0) | 406 (33,4) | 600 (31,9) | 0,022 |
| Dislipidemia, n (%) | 339 (57,9) | 736 (63,6) | 1112 (61,7) | 0,071 |
| Tabagismo, n (%) | 59 (9,7) | 259 (21,4) | 533 (27,8) | <0,001 |
| História familiar de doença coronária, n (%) | 20 (4,0) | 70 (6,9) | 130 (7,8) | 0,012 |
| EAM prévio, n (%) | 257 (41,7) | 301 (24,7) | 433 (22,6) | <0,001 |
| ICP prévia, n (%) | 118 (19,2) | 165 (13,5) | 343 (17,8) | 0,001 |
| Cirurgia de pontagem aorto‐coronária prévia, n (%) | 74 (12,0) | 74 (6,0) | 91 (4,7) | <0,001 |
| Doença vascular periférica, n (%) | 86 (14,3) | 85 (7,0) | 90 (4,7) | <0,001 |
| Comorbilidades | ||||
| Insuficiência cardíaca, n (%) | 153 (24,9) | 105 (8,6) | 95 (4,9) | <0,001 |
| Doença pulmonar obstrutiva crónica, n (%) | 52 (8,8) | 92 (7,5) | 110 (5,7) | 0,017 |
| Demência, n (%) | 42 (7,2) | 14 (1,2) | 14 (0,7) | <0,001 |
| AVC/AIT prévio, n (%) | 101 (16,4) | 141 (11,5) | 128 (6,7) | <0,001 |
| DRC, n (%) | 119 (20,3) | 85 (7,0) | 110 (5,8) | <0,001 |
| Dados laboratoriais | ||||
| Creatinina na admissão, mg/dl | <0,001 | |||
| ‐ Mediana | 1,1 | 0,9 | 0,9 | |
| ‐ Percentil 25 | 0,9 | 0,8 | 0,8 | |
| ‐ Percentil 75 | 1,6 | 1,2 | 1,1 | |
| Creatinina máxima, mg/dl | <0,001 | |||
| ‐ Mediana | 1,4 | 1,0 | 1,0 | |
| ‐ Percentil 25 | 1,0 | 0,9 | 0,9 | |
| ‐ Percentil 75 | 2,1 | 1,4 | 1,3 | |
| Glicemia, mg/dl | <0,001 | |||
| ‐ Mediana | 138 | 126 | 122 | |
| ‐ Percentil 25 | 109 | 104 | 102 | |
| ‐ Percentil 75 | 194 | 171 | 167 | |
| Hemoglobina na admissão, g/dL (média±DP) | 12,5±2,1 | 13,5±1,9 | 13,9±1,8 | <0,001 |
| Hemoglobina, valor mínimo, g/dL (média±DP) | 11,5±2,1 | 12,4±2,0 | 12,6±1,9 | <0,001 |
| Plaquetas, x106/L | 0,257 | |||
| ‐ Mediana | 203 | 206 | 209 | |
| ‐ Percentil 25 | 169 | 168 | 175 | |
| ‐ Percentil 75 | 248 | 250 | 248 | |
| BNP, pg/ml | <0,001 | |||
| ‐ Mediana | 475,0 | 240,0 | 133,0 | |
| ‐ Percentil 25 | 199,0 | 105,0 | 64,0 | |
| ‐ Percentil 75 | 1047,0 | 523,0 | 295,0 | |
| NT‐proBNP, pg/ml | <0,001 | |||
| ‐ Mediana | 5375,0 | 1027,5 | 833,0 | |
| ‐ Percentil 25 | 1970,0 | 348,0 | 280,0 | |
| ‐ Percentil 75 | 12800,0 | 3216,5 | 2680,0 | |
| Score GRACE – estratos de risco | ||||
| Risco baixo n (%) | 47 (8,3) | 248 (22,9) | 523 (30,1) | <0,001 |
| Risco intermédio n (%) | 129 (22,7) | 360 (33,2) | 627 (36,1) | |
| Risco alto n (%) | 393 (69,1) | 477 (44,0) | 587 (33,8) |
DP: desvio‐padrão.
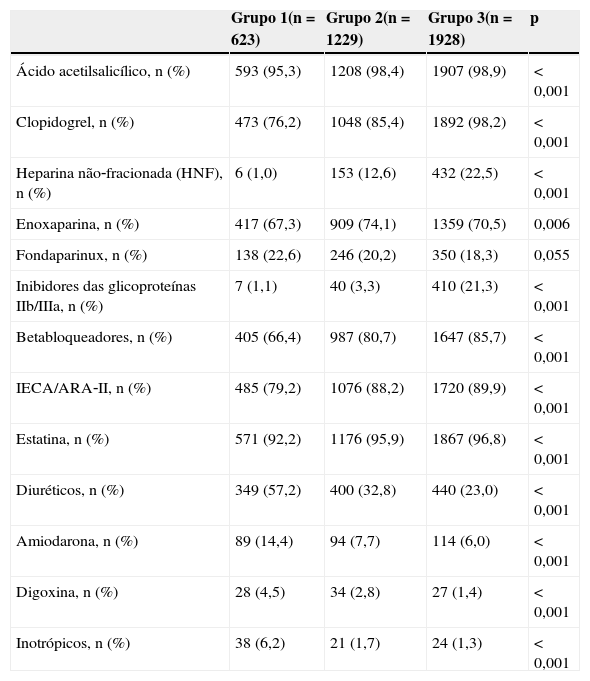
Na Tabela 2 é apresentada a terapêutica farmacológica cardiovascular realizada durante o internamento. A análise mostra que os doentes do grupo 1 usufruem menos de terapêuticas com comprovado benefício na diminuição da morbilidade e mortalidade no contexto de SCA, nomeadamente a antiagregação plaquetária, inibidores do sistema renina‐angiotensina‐aldosterona, betabloqueadores e estatinas. Por outro lado constata‐se a maior utilização de diuréticos e de inotrópicos neste grupo – provavelmente decorrente da maior prevalência de IC.
Terapêutica farmacológica realizada no internamento
| Grupo 1(n=623) | Grupo 2(n=1229) | Grupo 3(n=1928) | p | |
|---|---|---|---|---|
| Ácido acetilsalicílico, n (%) | 593 (95,3) | 1208 (98,4) | 1907 (98,9) | <0,001 |
| Clopidogrel, n (%) | 473 (76,2) | 1048 (85,4) | 1892 (98,2) | <0,001 |
| Heparina não‐fracionada (HNF), n (%) | 6 (1,0) | 153 (12,6) | 432 (22,5) | <0,001 |
| Enoxaparina, n (%) | 417 (67,3) | 909 (74,1) | 1359 (70,5) | 0,006 |
| Fondaparinux, n (%) | 138 (22,6) | 246 (20,2) | 350 (18,3) | 0,055 |
| Inibidores das glicoproteínas IIb/IIIa, n (%) | 7 (1,1) | 40 (3,3) | 410 (21,3) | <0,001 |
| Betabloqueadores, n (%) | 405 (66,4) | 987 (80,7) | 1647 (85,7) | <0,001 |
| IECA/ARA‐II, n (%) | 485 (79,2) | 1076 (88,2) | 1720 (89,9) | <0,001 |
| Estatina, n (%) | 571 (92,2) | 1176 (95,9) | 1867 (96,8) | <0,001 |
| Diuréticos, n (%) | 349 (57,2) | 400 (32,8) | 440 (23,0) | <0,001 |
| Amiodarona, n (%) | 89 (14,4) | 94 (7,7) | 114 (6,0) | <0,001 |
| Digoxina, n (%) | 28 (4,5) | 34 (2,8) | 27 (1,4) | <0,001 |
| Inotrópicos, n (%) | 38 (6,2) | 21 (1,7) | 24 (1,3) | <0,001 |
ARA‐II: antagonista dos recetores AT1 da angiotensina II; IECA: inibidor da enzima conversora da angiotensina.
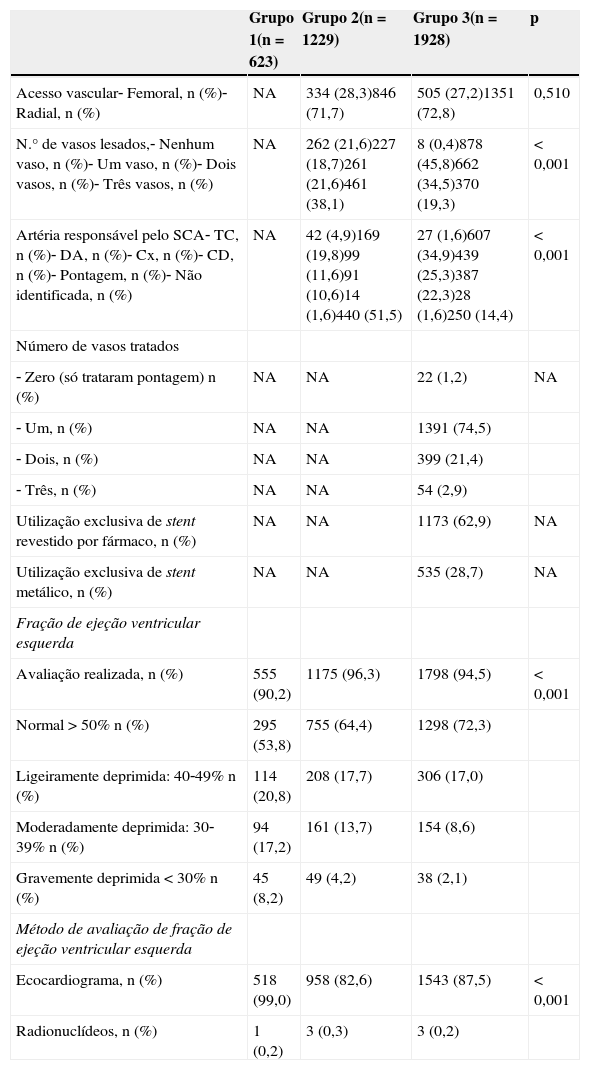
A Tabela 3 mostra as características da população nas variáveis relacionadas com o procedimento. Destaca‐se a ampla utilização do acesso radial em ambos os grupos de estratégia invasiva. Constata‐se a maior prevalência de doença do tronco comum e de doença de três vasos no grupo 2, enquanto o grupo 3 tem maior prevalência de doença de um vaso e de dois vasos. Destaca‐se também a prevalência elevada de vaso responsável pelo SCA não identificado no grupo 2. Relativamente ao tratamento por ICP verifica‐se que este foi executado sobretudo nos doentes com doença de um vaso.
Características da população – variáveis de procedimento e avaliação da função ventricular esquerda
| Grupo 1(n=623) | Grupo 2(n=1229) | Grupo 3(n=1928) | p | |
|---|---|---|---|---|
| Acesso vascular‐ Femoral, n (%)‐ Radial, n (%) | NA | 334 (28,3)846 (71,7) | 505 (27,2)1351 (72,8) | 0,510 |
| N.° de vasos lesados,‐ Nenhum vaso, n (%)‐ Um vaso, n (%)‐ Dois vasos, n (%)‐ Três vasos, n (%) | NA | 262 (21,6)227 (18,7)261 (21,6)461 (38,1) | 8 (0,4)878 (45,8)662 (34,5)370 (19,3) | <0,001 |
| Artéria responsável pelo SCA‐ TC, n (%)‐ DA, n (%)‐ Cx, n (%)‐ CD, n (%)‐ Pontagem, n (%)‐ Não identificada, n (%) | NA | 42 (4,9)169 (19,8)99 (11,6)91 (10,6)14 (1,6)440 (51,5) | 27 (1,6)607 (34,9)439 (25,3)387 (22,3)28 (1,6)250 (14,4) | <0,001 |
| Número de vasos tratados | ||||
| ‐ Zero (só trataram pontagem) n (%) | NA | NA | 22 (1,2) | NA |
| ‐ Um, n (%) | NA | NA | 1391 (74,5) | |
| ‐ Dois, n (%) | NA | NA | 399 (21,4) | |
| ‐ Três, n (%) | NA | NA | 54 (2,9) | |
| Utilização exclusiva de stent revestido por fármaco, n (%) | NA | NA | 1173 (62,9) | NA |
| Utilização exclusiva de stent metálico, n (%) | NA | NA | 535 (28,7) | NA |
| Fração de ejeção ventricular esquerda | ||||
| Avaliação realizada, n (%) | 555 (90,2) | 1175 (96,3) | 1798 (94,5) | <0,001 |
| Normal >50% n (%) | 295 (53,8) | 755 (64,4) | 1298 (72,3) | |
| Ligeiramente deprimida: 40‐49% n (%) | 114 (20,8) | 208 (17,7) | 306 (17,0) | |
| Moderadamente deprimida: 30‐39% n (%) | 94 (17,2) | 161 (13,7) | 154 (8,6) | |
| Gravemente deprimida <30% n (%) | 45 (8,2) | 49 (4,2) | 38 (2,1) | |
| Método de avaliação de fração de ejeção ventricular esquerda | ||||
| Ecocardiograma, n (%) | 518 (99,0) | 958 (82,6) | 1543 (87,5) | <0,001 |
| Radionuclídeos, n (%) | 1 (0,2) | 3 (0,3) | 3 (0,2) |
CD: coronária direita; Cx: circunflexa; DA: descendente anterior; TC: tronco comum; NA: não aplicável.
Por último, destaca‐se a existência de diferença significativa na avaliação da FEVE – que é menos frequentemente realizada no grupo da estratégia conservadora – e a diferença significativa no seu valor – que é inferior no grupo 1 e superior no grupo 3.
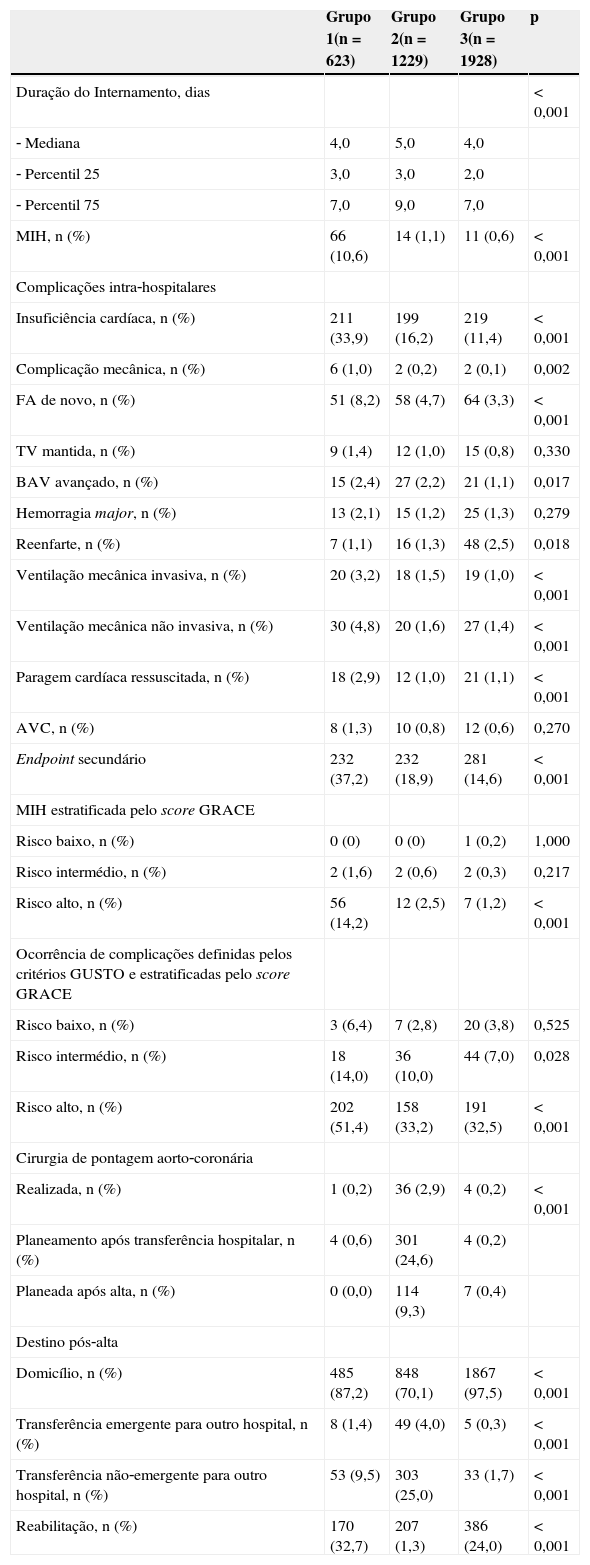
Complicações, mortalidade intra‐hospitalar e destino pós‐alta hospitalarA análise da Tabela 4 mostra a mediana da duração de internamento nos grupos, a MIH, a CIH e o destino após alta hospitalar.
Morte intra‐hospitalar, complicações intra‐hospitalares e destino pós‐alta
| Grupo 1(n=623) | Grupo 2(n=1229) | Grupo 3(n=1928) | p | |
|---|---|---|---|---|
| Duração do Internamento, dias | <0,001 | |||
| ‐ Mediana | 4,0 | 5,0 | 4,0 | |
| ‐ Percentil 25 | 3,0 | 3,0 | 2,0 | |
| ‐ Percentil 75 | 7,0 | 9,0 | 7,0 | |
| MIH, n (%) | 66 (10,6) | 14 (1,1) | 11 (0,6) | <0,001 |
| Complicações intra‐hospitalares | ||||
| Insuficiência cardíaca, n (%) | 211 (33,9) | 199 (16,2) | 219 (11,4) | <0,001 |
| Complicação mecânica, n (%) | 6 (1,0) | 2 (0,2) | 2 (0,1) | 0,002 |
| FA de novo, n (%) | 51 (8,2) | 58 (4,7) | 64 (3,3) | <0,001 |
| TV mantida, n (%) | 9 (1,4) | 12 (1,0) | 15 (0,8) | 0,330 |
| BAV avançado, n (%) | 15 (2,4) | 27 (2,2) | 21 (1,1) | 0,017 |
| Hemorragia major, n (%) | 13 (2,1) | 15 (1,2) | 25 (1,3) | 0,279 |
| Reenfarte, n (%) | 7 (1,1) | 16 (1,3) | 48 (2,5) | 0,018 |
| Ventilação mecânica invasiva, n (%) | 20 (3,2) | 18 (1,5) | 19 (1,0) | <0,001 |
| Ventilação mecânica não invasiva, n (%) | 30 (4,8) | 20 (1,6) | 27 (1,4) | <0,001 |
| Paragem cardíaca ressuscitada, n (%) | 18 (2,9) | 12 (1,0) | 21 (1,1) | <0,001 |
| AVC, n (%) | 8 (1,3) | 10 (0,8) | 12 (0,6) | 0,270 |
| Endpoint secundário | 232 (37,2) | 232 (18,9) | 281 (14,6) | <0,001 |
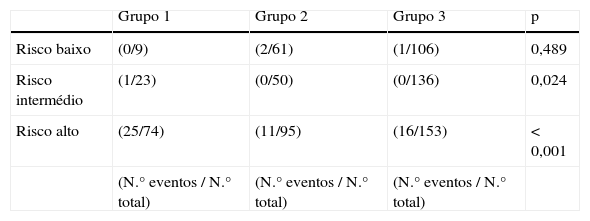
| MIH estratificada pelo score GRACE | ||||
| Risco baixo, n (%) | 0 (0) | 0 (0) | 1 (0,2) | 1,000 |
| Risco intermédio, n (%) | 2 (1,6) | 2 (0,6) | 2 (0,3) | 0,217 |
| Risco alto, n (%) | 56 (14,2) | 12 (2,5) | 7 (1,2) | <0,001 |
| Ocorrência de complicações definidas pelos critérios GUSTO e estratificadas pelo score GRACE | ||||
| Risco baixo, n (%) | 3 (6,4) | 7 (2,8) | 20 (3,8) | 0,525 |
| Risco intermédio, n (%) | 18 (14,0) | 36 (10,0) | 44 (7,0) | 0,028 |
| Risco alto, n (%) | 202 (51,4) | 158 (33,2) | 191 (32,5) | <0,001 |
| Cirurgia de pontagem aorto‐coronária | ||||
| Realizada, n (%) | 1 (0,2) | 36 (2,9) | 4 (0,2) | <0,001 |
| Planeamento após transferência hospitalar, n (%) | 4 (0,6) | 301 (24,6) | 4 (0,2) | |
| Planeada após alta, n (%) | 0 (0,0) | 114 (9,3) | 7 (0,4) | |
| Destino pós‐alta | ||||
| Domicílio, n (%) | 485 (87,2) | 848 (70,1) | 1867 (97,5) | <0,001 |
| Transferência emergente para outro hospital, n (%) | 8 (1,4) | 49 (4,0) | 5 (0,3) | <0,001 |
| Transferência não‐emergente para outro hospital, n (%) | 53 (9,5) | 303 (25,0) | 33 (1,7) | <0,001 |
| Reabilitação, n (%) | 170 (32,7) | 207 (1,3) | 386 (24,0) | <0,001 |
A MIH global foi de 2,0%, significativamente mais elevada no grupo 1. Constata‐se também que a MIH no estrato de risco alto do score GRACE é significativamente mais elevada no grupo da estratégia conservadora, o que não se verifica nos outros estratos de risco. Por outro lado, o endpoint secundário é mais frequente no grupo 1 (37,2% versus 18,9% versus 14,6%, p<0,001). Esta diferença constata‐se também na ocorrência de complicações definidas de acordo com os critérios GUSTO e estratificadas pelo score GRACE como sendo de risco intermédio e risco alto. Destaca‐se o facto de o reenfarte constituir a única complicação menos frequente no grupo 1.
Relativamente à realização de cirurgia de pontagem aorto‐coronária verifica‐se que o grupo 2 foi o mais frequentemente orientado para esta intervenção, o que está em consonância com a maior prevalência de doença de três vasos e de doença do tronco comum.
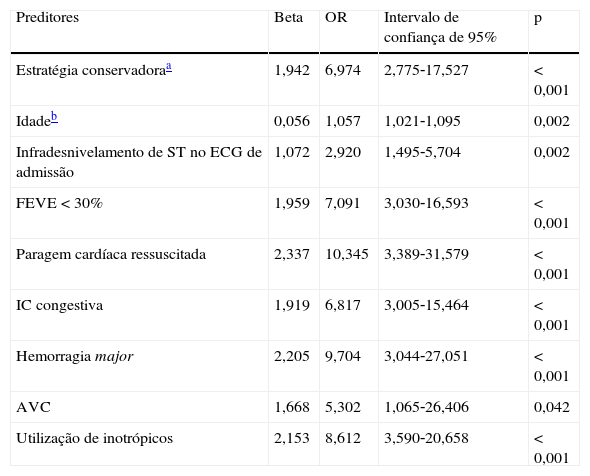
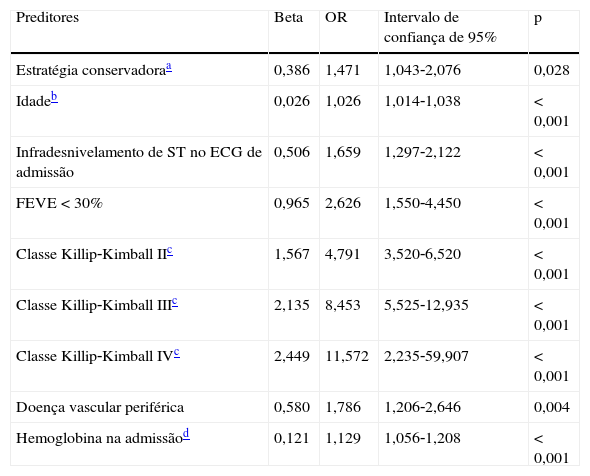
A análise multivariada permitiu identificar os preditores de MIH e dos preditores de CIH definidoras do endpoint secundário, que se encontram nas Tabelas 5 e 6.
Preditores de mortalidade intra‐hospitalar
| Preditores | Beta | OR | Intervalo de confiança de 95% | p |
| Estratégia conservadoraa | 1,942 | 6,974 | 2,775‐17,527 | <0,001 |
| Idadeb | 0,056 | 1,057 | 1,021‐1,095 | 0,002 |
| Infradesnivelamento de ST no ECG de admissão | 1,072 | 2,920 | 1,495‐5,704 | 0,002 |
| FEVE <30% | 1,959 | 7,091 | 3,030‐16,593 | <0,001 |
| Paragem cardíaca ressuscitada | 2,337 | 10,345 | 3,389‐31,579 | <0,001 |
| IC congestiva | 1,919 | 6,817 | 3,005‐15,464 | <0,001 |
| Hemorragia major | 2,205 | 9,704 | 3,044‐27,051 | <0,001 |
| AVC | 1,668 | 5,302 | 1,065‐26,406 | 0,042 |
| Utilização de inotrópicos | 2,153 | 8,612 | 3,590‐20,658 | <0,001 |
p: valor do teste Hosmer‐Lemeshow 0,271; área sob a curva ROC (IC a 95%): 0,960 (0,939‐0,982); sensibilidade do modelo 93,9%; especificidade do modelo 87,9%.
Preditores de complicações intra‐hospitalares
| Preditores | Beta | OR | Intervalo de confiança de 95% | p |
| Estratégia conservadoraa | 0,386 | 1,471 | 1,043‐2,076 | 0,028 |
| Idadeb | 0,026 | 1,026 | 1,014‐1,038 | <0,001 |
| Infradesnivelamento de ST no ECG de admissão | 0,506 | 1,659 | 1,297‐2,122 | <0,001 |
| FEVE <30% | 0,965 | 2,626 | 1,550‐4,450 | <0,001 |
| Classe Killip‐Kimball IIc | 1,567 | 4,791 | 3,520‐6,520 | <0,001 |
| Classe Killip‐Kimball IIIc | 2,135 | 8,453 | 5,525‐12,935 | <0,001 |
| Classe Killip‐Kimball IVc | 2,449 | 11,572 | 2,235‐59,907 | <0,001 |
| Doença vascular periférica | 0,580 | 1,786 | 1,206‐2,646 | 0,004 |
| Hemoglobina na admissãod | 0,121 | 1,129 | 1,056‐1,208 | <0,001 |
P: valor do teste Hosmer‐Lemeshow 0,169; área sob a curva ROC (IC a 95%): 0,899 (0,885‐0,912); sensibilidade do modelo 82,0%; especificidade do modelo 83,9%.
Os preditores de MIH foram a adoção de estratégia conservadora, a idade, infradesnivelamento do segmento ST no ECG de admissão, depressão grave da FEVE, a ocorrência de paragem cardíaca ressuscitada, ou de IC congestiva, ou de hemorragia major ou de AVC e a utilização de inotrópicos. A realização de coronariografia e não‐realização de ICP não foi um preditor identificado de MIH (OR 1,737; IC95% [0,617‐4,891], p=0,296).
Os preditores identificados de CIH definidas no endpoint secundário foram: adoção de estratégia conservadora, idade, infradesnivelamento do segmento ST no ECG de admissão, depressão grave da FEVE, classe Killip‐Kimball >I na admissão, a doença vascular periférica e o valor da hemoglobina inicial. A realização de coronariografia e não‐realização de ICP não foi um preditor identificado de CIH definidas no endpoint secundário (OR 0,933; IC95% [0,701‐1,243], p=0,637).
Em notável contraste com outra outras estratégias terapêuticas constata‐se que os doentes submetidos a estratégia conservadora são os mais frequentemente encaminhados para realização de reabilitação cardíaca.
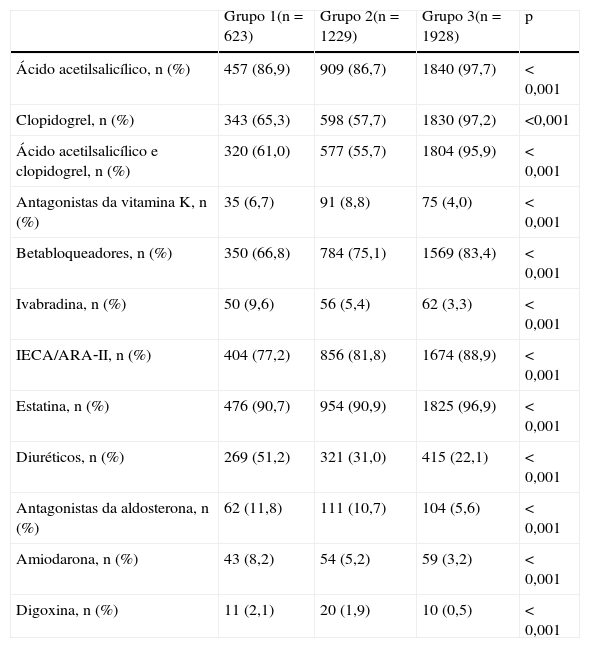
Medicação na alta hospitalarA Tabela 7 mostra a medicação prescrita à data de alta hospitalar; destaca‐se a menor utilização de dupla antigregação plaquetária, de betabloqueadores e de IECA/ARA‐II nos doentes submetidos a estratégia conservadora. Por outro lado, estes têm as mais elevadas taxas de prescrição de diuréticos de ansa, de antagonistas da aldosterona, amiodarona e digoxina – o que está em concordância com a maior prevalência de IC e FA.
Terapêutica farmacológica prescrita na alta hospitalar
| Grupo 1(n=623) | Grupo 2(n=1229) | Grupo 3(n=1928) | p | |
| Ácido acetilsalicílico, n (%) | 457 (86,9) | 909 (86,7) | 1840 (97,7) | <0,001 |
| Clopidogrel, n (%) | 343 (65,3) | 598 (57,7) | 1830 (97,2) | <0,001 |
| Ácido acetilsalicílico e clopidogrel, n (%) | 320 (61,0) | 577 (55,7) | 1804 (95,9) | <0,001 |
| Antagonistas da vitamina K, n (%) | 35 (6,7) | 91 (8,8) | 75 (4,0) | <0,001 |
| Betabloqueadores, n (%) | 350 (66,8) | 784 (75,1) | 1569 (83,4) | <0,001 |
| Ivabradina, n (%) | 50 (9,6) | 56 (5,4) | 62 (3,3) | <0,001 |
| IECA/ARA‐II, n (%) | 404 (77,2) | 856 (81,8) | 1674 (88,9) | <0,001 |
| Estatina, n (%) | 476 (90,7) | 954 (90,9) | 1825 (96,9) | <0,001 |
| Diuréticos, n (%) | 269 (51,2) | 321 (31,0) | 415 (22,1) | <0,001 |
| Antagonistas da aldosterona, n (%) | 62 (11,8) | 111 (10,7) | 104 (5,6) | <0,001 |
| Amiodarona, n (%) | 43 (8,2) | 54 (5,2) | 59 (3,2) | <0,001 |
| Digoxina, n (%) | 11 (2,1) | 20 (1,9) | 10 (0,5) | <0,001 |
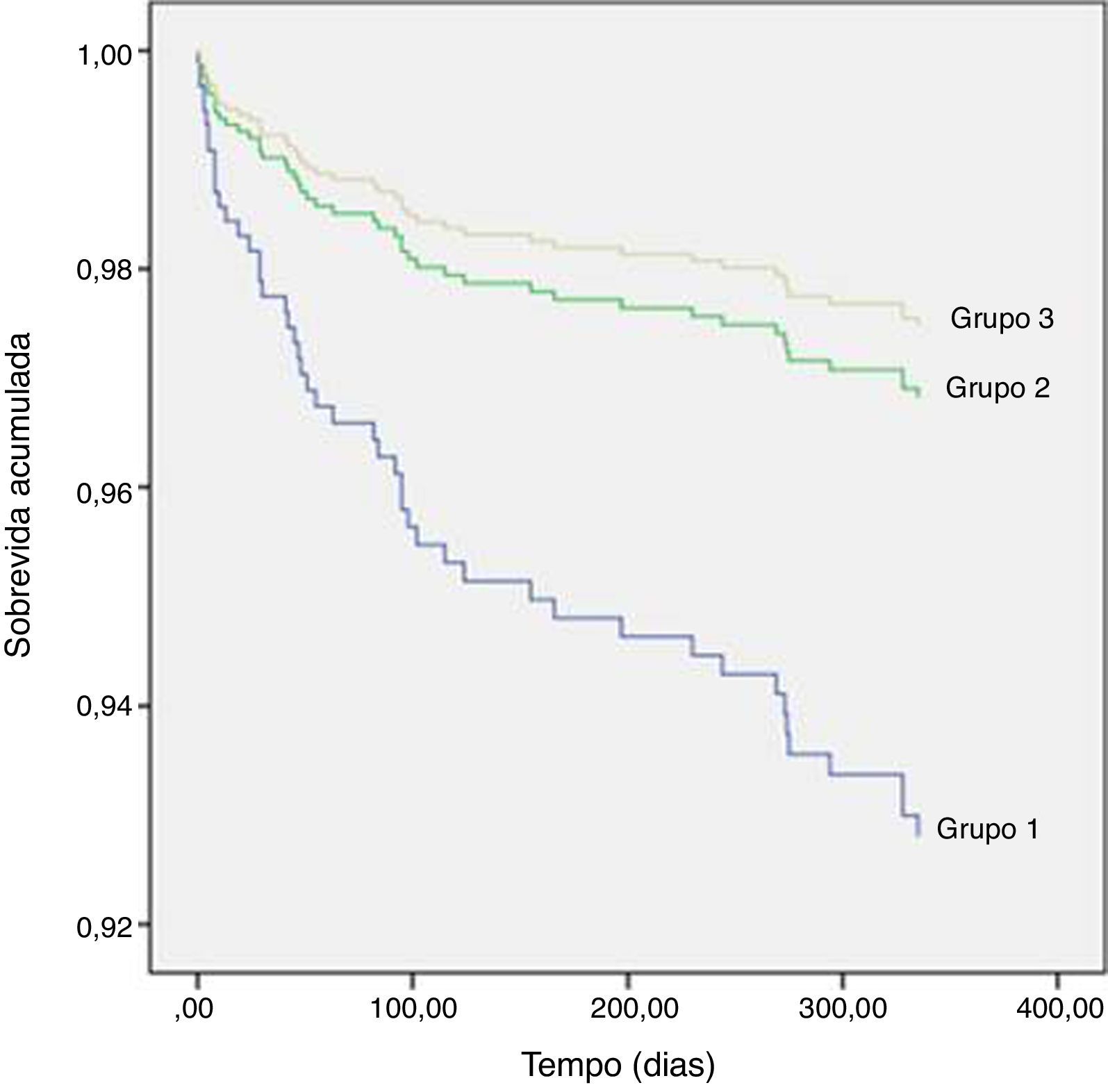
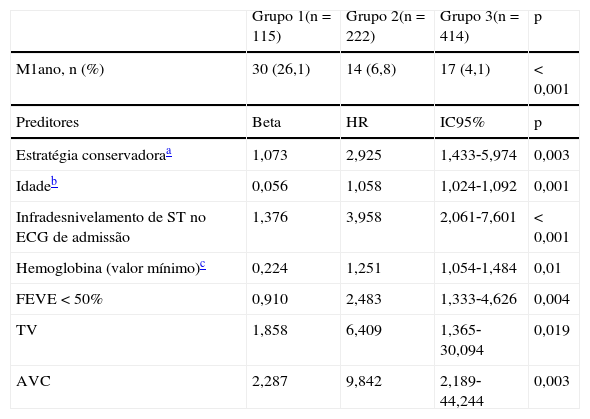
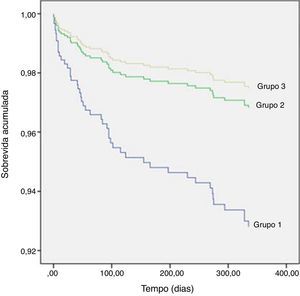
A análise da Tabela 8 mostra que a M1ano é significativamente superior no grupo 1. Para a construção do modelo de regressão de Cox foram incluídos 564 doentes; o número de mortos ao fim de um ano foi de 48 (8,5%). Os preditores de M1ano foram a adoção de estratégia conservadora, a idade, infradesnivelamento do segmento ST no ECG de admissão, FEVE<50%, o valor mínimo da hemoglobina e a ocorrência de TV ou de AVC durante o internamento. A realização de coronariografia e não‐realização de ICP não foi um preditor de M1ano (HR 1,267; IC95% [0,573‐2,8], p=0,559). A Figura 1 mostra as curvas de Cox da evolução da mortalidade nos grupos ao longo do período de um ano.
Mortalidade ao ano após alta hospitalar e respetivos preditores
| Grupo 1(n=115) | Grupo 2(n=222) | Grupo 3(n=414) | p | |
| M1ano, n (%) | 30 (26,1) | 14 (6,8) | 17 (4,1) | <0,001 |
| Preditores | Beta | HR | IC95% | p |
| Estratégia conservadoraa | 1,073 | 2,925 | 1,433‐5,974 | 0,003 |
| Idadeb | 0,056 | 1,058 | 1,024‐1,092 | 0,001 |
| Infradesnivelamento de ST no ECG de admissão | 1,376 | 3,958 | 2,061‐7,601 | <0,001 |
| Hemoglobina (valor mínimo)c | 0,224 | 1,251 | 1,054‐1,484 | 0,01 |
| FEVE <50% | 0,910 | 2,483 | 1,333‐4,626 | 0,004 |
| TV | 1,858 | 6,409 | 1,365‐30,094 | 0,019 |
| AVC | 2,287 | 9,842 | 2,189‐44,244 | 0,003 |
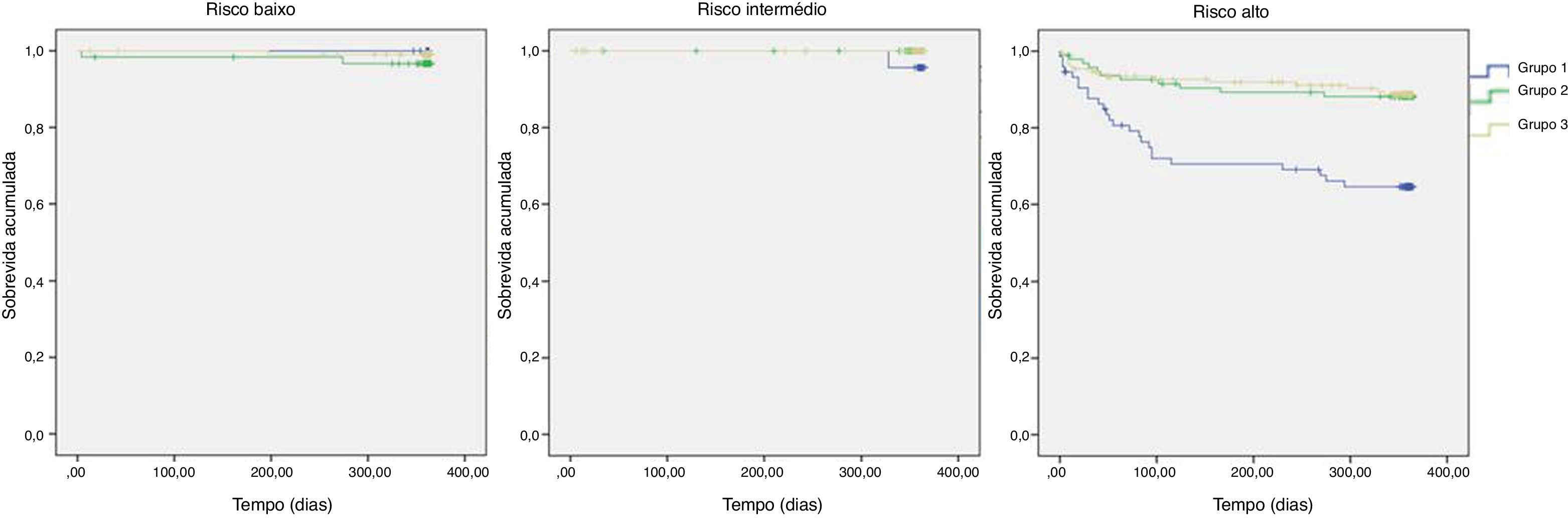
A Tabela 9 mostra que, com estratificação pelo score GRACE, a M1ano é significativamente superior nos estratos de risco intermédio e alto; a Figura 2 mostra as curvas de Kaplan‐Meier da evolução da mortalidade nos três estratos ao longo deste período.
A análise dos determinantes da decisão de revascularização no EAMSST é complexa, dada a heterogeneidade desta população em termos de risco e de prognóstico2. Por conseguinte, é recomendada a estratificação do risco de modo a identificar os doentes com risco elevado de morte e eventos cardiovasculares a curto prazo e a longo prazo com o objetivo de instituir estratégia invasiva precoce e terapêutica médica otimizada2,3. É recomendada a instituição de estratégia invasiva imediata (<2h) nos doentes com isquemia refratária, choque cardiogénico ou com instabilidade hemodinâmica ou elétrica e de estratégia invasiva precoce (<24h) em doentes com pelo menos um critério primário de alto risco (Tabela 10). Nos doentes com score GRACE<140 e um critério secundário de alto risco (Tabela 10) a estratégia invasiva deve ser realizada preferencialmente até às 72h após admissão. Nos doentes de baixo risco, sem sintomas recorrentes, deve avaliar‐se a isquemia induzível de forma não‐invasiva previamente à alta. No entanto, e em conformidade com o demonstrado em meta‐análises de ensaios clínicos10,11, considera‐se que a adoção de estratégia invasiva rotineira pode ser realizada. A meta‐análise de Hoenig et al.10 incidiu nos ensaios Treat Angina With Aggrastat and Determine the Cost of Therapy With an Invasive or Conservative Strategy (TACTICS‐TIMI 18), Value of first day angiography/Angioplasty In evolving Non‐ST segment elevation myocardial infarction, an Open multicenter randomized trial (VINO), Fragmin during Instability in Coronary Artery Disease (FRISC-II), Invasive versus Conservative Treatment in Unstable Coronary Syndromes (ICTUS) e Randomized Intervention Trial of unstable Angina-3 (RITA-3) e mostra que a adoção de estratégia invasiva na angina instável (AI)/EAMSST resulta numa diminuição relativa de 33% do risco nos endpoints de angina refratária e de reinternamento aos seis a 12 meses. Demonstra também que, apesar da estratégia invasiva estar associada a um aumento de duas vezes no risco de periprocedimento de EAM, há uma significativa diminuição de 27 e 22% de redução do risco relativo de EAM aos seis a 12 meses e de três a cinco anos, respetivamente. A meta‐análise de Fox et al.11 incidiu sobre os ensaios FRISC‐II, ICTUS e RITA‐3 e mostrou que a estratégia invasiva rotineira em doentes com EAMSST versus estratégia invasiva seletiva diminuiu a mortalidade cardiovascular ou a ocorrência de EAM ao longo de um período de cinco anos, com a diferença mais pronunciada nos doentes de alto risco. A idade, diabetes mellitus, EAM prévio, infradesnivelamento do segmento ST, HTA, IMC inferior a 25kg/m2 ou superior a 35kg/m2 e a estratégia de tratamento adotada demonstraram ser preditores independentes de morte ou EAM não‐fatal ao longo do período de seguimento clínico11. Os dados obtidos a partir de registos1 mostram que a estratégia invasiva rotineira está associada à diminuição do endpoint combinado de morte e EAM com a diferença relativamente à estratégia conservadora a ser principalmente determinada pelo aumento da mortalidade.
Critérios de alto risco com indicação de estratégia invasiva (Adaptado de: Windecker et al.3)
| Critérios primários |
| 1. Elevação ou diminuição relevante da troponina |
| 2. Alterações dinâmicas do segmento ST ou da onda T (sintomáticas ou assintomáticas) |
| 3. Score GRACE >140 |
| Critérios secundários |
| 4. Diabetes mellitus |
| 5. Doença renal crónica (TFG <60mL/min/1,73m2) |
| 6. FEVE <40% |
| 7. Angina pós‐enfarte precoce |
| 8. ICP recente |
| 9. Pontagem aorto‐coronária prévia |
| 10. Score GRACE intermédio a alto |
TFG: taxa de filtração glomerular.
Apesar de toda esta evidência verifica‐se que a relação entre o risco do doente e a realização de estratégia invasiva é inversa5,8, situação também determinada no registo apresentado por Puymirat et al.1 que mostra que os doentes submetidos a estratégia invasiva eram mais novos e tinham score GRACE mais baixo do que os submetidos a estratégia conservadora.
O presente trabalho englobou vários centros nacionais e pretendeu analisar, numa população de doentes do mundo real e com base num registo multicêntrico e com critérios de inclusão uniformes, a dimensão e o impacto da estratégia conservadora no EAMSST.
Destacam‐se as diferenças já constatadas noutros registos, nomeadamente a idade média mais elevada, a maior prevalência do género feminino e de critérios de alto risco – traduzidos também nos estratos de score GRACE – no grupo de doentes submetido a estratégia conservadora; este também usufrui menos de terapêutica farmacológica com comprovado benefício na diminuição da morbilidade e mortalidade no contexto de SCA2 pelo que também se constata o paradoxo entre o risco do doente e a estratégia adotada.
A estratégia conservadora é um preditor independente de MIH e M1ano – que definem o endpoint primário − e de CIH que definem o endpoint secundário, em conformidade com outros estudos1,10,11. No entanto, constata‐se que com a estratificação pelo score GRACE não há diferença na MIH nos estratos de risco baixo e intermédio, o que contrasta com a evidência existente2,8; uma eventual explicação para este resultado pode residir no número reduzido de mortes verificadas nestes estratos, o que pode dificultar a deteção de diferenças que podem efetivamente existir na população de onde foi extraída a amostra estudada. Relativamente à M1ano constata‐se que é significativamente mais elevada nos estratos de risco intermédio e de risco alto. Este padrão de relação significativa com o estrato de risco intermédio e de risco alto é também verificado na ocorrência de complicações definidas pelos critérios GUSTO.
Estes resultados suscitam a reflexão sobre os determinantes de não realização de estratégia invasiva nomeadamente as comorbilidades não cardíacas e uma possível não utilização adequada dos scores de risco isquémico.
Das CIH ocorridas no internamento destaca‐se a ocorrência de reenfarte, mais frequente nos doentes submetidos a estratégia invasiva − ao contrário do descrito12 − e particularmente nos doentes com vaso tratado por ICP. A definição de reenfarte utilizada neste trabalho que, por exemplo, não especifica o vaso em que ocorre o novo evento − assim como a definição de vaso tratado por ICP, que apenas considera um sucesso angiográfico imediato e não o sucesso de procedimento ou o sucesso clínico13, não permite clarificar categoricamente a sua causa, suscitando, por exemplo, a questão do papel da revascularização incompleta neste resultado.
Dos outros preditores de MIH, M1ano e CIH definidoras do endpoint secundário destaca‐se a idade14,15 que, per se, se associa a menor probabilidade de adoção de estratégia invasiva16,17, situação relevante devido à crescente preponderância da patologia cardiovascular numa população cada vez mais envelhecida4,18.
Neste trabalho destaca‐se também a heterogeneidade dos doentes submetidos a coronariografia e não submetidos a ICP; em 21,6% destes doentes não foi identificada doença coronária angiograficamente significativa e 36,8% foram referenciados para cirurgia de pontagem aorto‐coronária pelo que se constata que 41,6% tinham doença coronária significativa, mas não foram submetidos a revascularização. Apesar da heterogeneidade existente neste grupo constata‐se que tem melhor prognóstico do que o grupo dos doentes submetidos a estratégia conservadora pelo que é realçada a importância da avaliação da anatomia coronária no estabelecimento da estratégia terapêutica a adotar.
Ao contrário do descrito na literatura2, a estratégia conservadora não está associada a maior duração de internamento. Apesar de os dados não permitirem determinar o motivo, tal situação pode dever‐se ao facto do grupo 2 ter a menor percentagem de alta para o domicílio e as mais altas percentagens de transferência inter‐hospitalar, o qual poderá estar associado à maior prevalência de doentes com indicação cirúrgica. No entanto, o desenho do estudo não permite afirmar relação de causalidade.
LimitaçõesO estudo apresenta as limitações existentes em todos os registos, pois nem todos os centros em Portugal participam no RNSCA e os participantes não incluem todos os seus doentes. Devido à limitação do formato do registo, não são explícitas as razões da não realização de estratégia invasiva, nomeadamente as preferências dos doentes ou contraindicações. Possui também as limitações existentes em todos os estudos observacionais, nomeadamente a impossibilidade de afirmação de causalidade em parâmetros que se encontram a ser correlacionados e também o facto das comparações entre as diferentes estratégias terapêuticas não terem sido definidas aleatoriamente. Por conseguinte, os resultados apenas se podem considerar como indicativos.
ConclusãoO presente estudo é o resultado da prática clínica do mundo real e mostra que a estratégia conservadora nos doentes com EAMSST está associada a maior ocorrência de MIH, CIH e de morte até um ano após a alta hospitalar.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.