Neste artigo fazemos referência a um caso de reestenose muito tardia de um stent convencional que, através de duas técnicas de diagnóstico intracoronário, ultrassonografia intravascular (IVUS) e tomografia de coerência ótica (OCT), permite dar a conhecer o seu mecanismo subjacente (neoaterosclerose) e facilita o seu tratamento percutâneo (stent convencional direto intrasent). Aproveitamos também a ocasião para fazer uma breve descrição das vantagens e limitações de ambas as técnicas neste tipo de patologia.
We report a case of very late bare-metal stent restenosis, in which assessment by two intracoronary imaging techniques (intravascular ultrasound and optical coherence tomography) revealed the underlying mechanism (neoatherosclerosis) and facilitated percutaneous treatment (direct bare-metal stent-in-stent). We also take the opportunity to briefly describe the advantages and limitations of both techniques in this pathology.
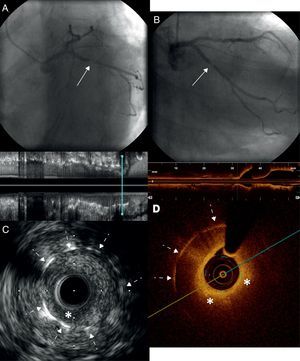
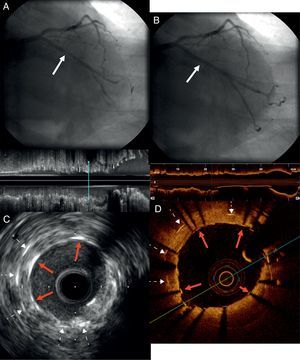
Homem de 73 anos, com antecentes de fibrilhação auricular permanente anticoagulada e de cardiopatia isquémica crónica revascularizada em 2002 com dois stents não revestidos (BMS) na artéria circunflexa (CX). Foi-lhe prescrita uma coronariografia em 2013 devido a angina instável, na qual se detetou a presença de uma reestenose intrastent (RIS) focal e grave do BMS implantado no segmento proximal da CX (Figura 1A e 1B). Para uma melhor compressão do mecanismo causal e tipo de RIS esta artéria foi avaliada mediante ultrassonografia intravascular (IVUS), evidenciando uma reestenose focal com imagem hipoecoica e heterogénea sobre a adventícia (Figura 1C). Para uma melhor avaliação do tecido da reestenose realizou-se também uma tomografia de coerência ótica (OCT), que revelou a existência de neoaterosclerose, com uma imagem sugestiva de placa lipídica ao nível do da RIS, caracterizando-se por ser hipointensa e com elevada atenuação, o que dificultava a visualização dos struts do stent (Figura 1D). Perante estes resultados foi implantado de uma forma direta um intrastent BMS (3,0mm x 12mm a 16atm) (Figura 2A), comprovando-se tanto por angiografia (Figura 2B) como por IVUS e OCT (Figura 2C e 2D) a adequada expansão e colocação do mesmo.
A e B – reestenose intrastent angiográfica grave ao nível do segmento proximal da CX (setas contínuas) com o fluxo distal TIMI 3. C – avaliação da reestenose com IVUS: tecido heterogéneo com presença de áreas hipoecogénicas a nível superficial (*), com adequada expansão do stent previamente implantado em 2002 e sem dados de fratura (setas descontínuas). D –avaliação da reestenose com OCT: neointimal de aspeto lipídico, rodeada por uma cápsula fibrosa hiperintensa e formada por um tecido de baixa intensidade, com limites mal definidos e elevada atenuação (*), o que origina uma sombra que limita a visualização dos struts do stent (setas descontínuas).
A – posicionamento de um intrastent BMS ao nível da reestenose (seta contínua). B – resultado angiográfico do implante direto do stent sem estenose residual significativa (seta contínua). C e D – avaliação através de IVUS e de OCT do novo stent implantado, com adequada expansão do mesmo e colocação completa de todos os struts (setas contínuas encarnadas). Setas descontínuas: struts do stent implantado em 2002.
Tradicionalmente o tratamento percutâneo da RIS tem sido considerado um desafio devido às características do tecido da hiperplasia neointimal, as quais condicionavam-no por resistência especial à dilatação e uma clara tendência para reincidência1. No entanto, o reconhecimento recente da neoaterosclerose como substrato responsável por um número significativo de RIS reinicia o interesse pelo estudo dos seus mecanismos etiológicos e abordagens terapêuticas2. Este fenómeno visível no aparecimento de alterações ateroscleróticas (depósitos de cálcio, núcleos lipídicos, cristais de colesterol, etc.) na neointimal, que abrange não só os BMS como os stents revestidos (DES), é devido (pelo menos em parte) à inflamação e disfunção endotelial que os dois tipos de stent originam na parede da artéria. Dadas as suas caraterísticas, é fácil entender que a rotura e exposição à circulação sanguínea do seu conteúdo altamente protrombótico possam também ser responsáveis por um elevado número de tromboses tardias provocadas por stent2–5.
É conhecido o papel diagnóstico que podem desempenhar a OCT e a IVUS para quantificar a percentagem da estenose e a amplitude da RIS, para precisar a localização da RIS em relação ao stent (limites e proliferação, etc.) ou para detetar possíveis fatores mecânicos implicados no seu desenvolvimento (infraexpansão, fraturas do stent, etc.)1. Tal como mostrámos, a deteção de um elevado conteúdo lipídico na RIS permite optar por uma implantação direta do stent, sem realizar nenhum tipo de pré-dilatação, reduzindo por esse motivo os riscos de deslocação ou de embolização da placa, reestenoses futuras e/ou revascularizações por disseção dos limites ao deslocar-se o balão durante a sua inflação e a despesa motivada pelo uso de um ou vários tipos de balão (compliant, no compliant, cutting, etc.). Apesar de já ter sido referido que os DES obtêm os melhores resultados clínicos e angiográficos após o tratamento percutâneo da RIS, comparativamente aos BMS1, a sua atuação na RIS causada por neoaterosclerose não foi ainda estudada. Sabe-se, pelo contrário, que a neoaterosclerose é um fenómeno mais frequente e precoce nos DES2,5, necessitando estes de um período mais prolongado de dupla antiagregação. Por estes motivos e pela necessidade de anticoagulação do nosso doente, foi decidido implantar um novo intrastent BMS, sendo possível confirmar através de ambas as técnicas o resultado correto do implante sem que se considerasse necessário realizar nenhum tipo de pós-dilatação.
Como se observa nas figuras, longe de se tratarem de técnicas exclusivas, as duas apresentam vantagens e limitações. No que se refere a OCT, a sua maior resolução espacial permite uma melhor visualização e discriminação do tecido que forma a RIS, se bem que a atenuação provocada pelo núcleo necrótico produz uma sombra que não permite visualizar os struts a esse nível, o que poderia fazer passar despercebida uma infraexpansão ou fratura do stent que fossem responsáveis pela RIS. Além disso, para uma adequada avaliação da RIS com OCT é necessário encher o lúmen coronário com contraste expulsando o sangue, aspeto que pode limitar a qualidade das imagens na presença de RIS oclusivas ou ostiais que não permitem um correto preenchimento com contraste. A maior penetração da IVUS facilita uma adequada avaliação e medição de toda a parede arterial e, ao não apresentar o fenómeno de atenuação com o núcleo necrótico, pode-se observar totalmente o estado de todos os struts ao longo da circunferência do stent.
Em conclusão, o nosso caso ilustra o papel fundamental que as técnicas de diagnóstico intracoronário desempenham para o diagnóstico e caracterização da RIS, bem como planificar e conduzir ao tratamento percutâneo da mesma.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.