Os benefícios demonstrados com a terapêutica de ressincronização cardíaca (TRC) na redução da mortalidade e hospitalização por ICC, melhoria da classe funcional e obtenção de remodelagem inversa em doentes selecionados com insuficiência cardíaca (ICC), têm contribuído para a crescente utilização destes dispositivos na prática clínica.
No entanto, permanece controverso o impacto da TRC como fator causador de arritmias ventriculares complexas. Apresentamos o caso duma doente com cardiopatia valvular operada, disfunção sistólica grave e ICC classe III da NYHA, com terapêutica médica otimizada, sem documentação prévia de arritmias ventriculares significativas. Após implantação do sistema de TRC com cardioversor‐desfibrilhador, desenvolveu quadro de tempestade arrítmica com múltiplos episódios de taquicardia ventricular monomórfica (TV) e necessidade de 12 choques, mantendo padrão de bigeminismo ventricular reprodutível e indução de salvas de TV pelo pacing biventricular. Dada a inacessibilidade a outra veia tributária do seio coronário foi decidido implantar elétrodo epicárdico em localização diferente (de veia póstero‐lateral para posição lateral‐mediana), sem registo de recorrência de arritmias num follow‐up de seis meses. Este caso sugere que a TRC pode contribuir para um efeito pró‐arrítmico com consequências clínicas potencialmente graves.
The demonstrated benefits of cardiac resynchronization therapy (CRT) in reducing mortality and hospitalizations for heart failure, improving NYHA functional class and inducing reverse remodeling have led to its increasing use in clinical practice. However, its potential contribution to complex ventricular arrhythmias is controversial.We present the case of a female patient with valvular heart failure and severe systolic dysfunction, in NYHA class III and under optimal medical therapy, without previous documented ventricular arrhythmias. After implantation of a CRT defibrillator, she suffered an arrhythmic storm with multiple episodes of monomorphic ventricular tachycardia (VT), requiring 12 shocks. Subsequently, a pattern of ventricular bigeminy was observed, as well as reproducible VT runs induced by biventricular pacing.
Since no other vein of the coronary sinus system was accessible, it was decided to implant an epicardial lead to stimulate the left ventricle, positioned in the left ventricular mid‐lateral wall. No arrhythmias were detected in the following six months.
This case highlights the possible proarrhythmic effect of biventricular pacing with a left ventricular lead positioned in the coronary sinus venous system.
Os benefícios obtidos com a terapêutica de ressincronização cardíaca (TRC) na redução da mortalidade, das hospitalizações por insuficiência cardíaca (ICC) na melhoria da classe funcional e obtenção de remodelagem inversa, têm sido largamente demonstrados por vários ensaios multicêntricos realizados na última década, o que originou uma assinalável expansão das indicações para pacing biventricular1–8.
A TRC pode apresentar efeitos adversos, a maioria dos quais relacionados com complicações dos procedimentos de implantação, com infeções ou com disfunção do sistema. No entanto, nos últimos anos tem sido motivo de debate um potencial contributo do pacing biventricular para a ocorrência de arritmias ventriculares complexas.
Caso clínicoDoente do sexo feminino, de 58 anos, com hipertensão arterial ligeira controlada, diabetes mellitus tipo 2 e dislipidemia, seguida em consulta externa de cardiologia por ICC de etiologia valvular e fibrilhação auricular permanente. A doente tinha sido previamente submetida a substituição da válvula mitral por prótese mecânica devido a estenose mitral grave.
No seguimento subsequente verificou‐se deterioração clínica progressiva, passando a evoluir em classe III da NYHA sob terapêutica médica otimizada (TMO) e no ECG tinha QRS com duração de 150ms, e padrão de bloqueio completo de ramo esquerdo. Não tinha havido história de disritmia ventricular durante o seguimento realizado previamente. Os ecocardiogramas seriados mostraram deterioração progressiva da função sistólica global (fração de ejeção desceu de 24 para 13%). Seis anos após a cirurgia de substituição da válvula mitral apresentava má função sistólica global, com diâmetro telediastólico do ventrículo esquerdo (VE) de 82mm; fração de ejeção estimada em 13% (por Simpson modificado), com critérios ecocardiográficos de dessincronia intraventricular (Tissue Synchronization imaging ‐ TSI: atraso lateral de 100ms; com 2DStrain: strain radial de 448ms com atraso ântero‐septal inferior), sem dessincronia interventricular (tempos de pré‐ejeção pulmonar de 78ms e aórtico de 105ms). A função ventricular direita também estava comprometida, com TAPSE de 5mm.
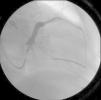
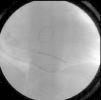
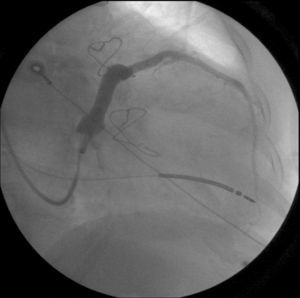
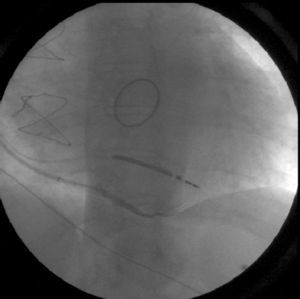
Procedeu‐se a implantação de TRC‐D VVIR, com eletrocateter ventricular esquerdo posicionado numa veia posterior basal (Figura 1), com óstio independente do seio coronário, cuja rede venosa tributária era pobre e constituída por vasos bastante finos e com angulação excessiva (Figura 2). Realça‐se que, na experiência do nosso centro, esta veia constitui uma alternativa frequente quando as veias tributárias do seio coronário são tecnicamente inadequadas, apesar de habitualmente ser de difícil cateterização. No entanto, esta alternativa constitui apenas uma solução de recurso, na medida em que, a partir do ápex do ventrículo direito e desta localização no ventrículo esquerdo, não proporciona uma distância têmporo‐espacial suficientemente ampla para a ativação miocárdica. Além disso, o facto de ambos os eletrocateteres ativarem a massa ventricular a partir de posições não muito distantes, pode eventualmente gerar nova dessincronia em face da ativação tardia das porções mais distantes do miocárdio.
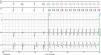
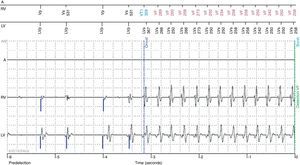
Um mês após a implantação, a doente recorre ao nosso serviço por ter sofrido uma sequência de 12 choques em 24 horas. A interrogação do dispositivo mostrou que foram choques apropriados em resposta a tempestade arrítmica com vários episódios de taquicardia ventricular (TV) rápida com ciclo de 250ms (Figura 3). Verificava‐se naquela altura padrão de bigeminismo ventricular reprodutível e indução de salvas de TV pelo pacing biventricular. Fizeram‐se testes com várias programações com diferentes polaridades, amplitudes e larguras de impulso, bem como com pacing ventricular esquerdo isolado, no entanto nenhuma das alterações aboliu a extrassistolia ventricular. Perante o insucesso destas tentativas, foi desligado o pacing mediado pelo eletrocateter ventricular esquerdo, ficando a doente em ritmo próprio, sem extrassístoles ventriculares, e com frequência mínima de pacing ventricular direito programada para 40bpm. O cardioversor‐desfibrilhador ficou programado com três zonas: TV‐1 a partir de 171bpm com terapia com dois bursts; TV‐2 a partir de 182bpm com terapia com duas rampas seguidas se necessário de choque com energia de 40J; e zona de FV a partir de 200bpm; com terapia com até seis choques de 40J.
Um registo de Holter de 24 horas, realizado dois meses mais tarde, mostrava ritmo próprio (FA) em 99% do registo, com apenas 195 extrassístoles ventriculares isoladas e dimórficas, um par e uma salva de quatro complexos (sob terapêutica com 200mg/dia de amidarona e carvedilol 6,25mg 2id).
Num ecocardiograma realizado no 5.° mês após desligar a função de pacing no VE, a fração de ejeção continuava muito baixa (13%), com evidência de dessincronia intraventricular e interventricular, mantendo‐se em classe III da NYHA.
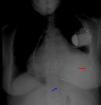
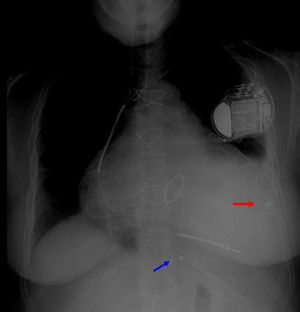
Foi decidido levar a cabo nova tentativa de introdução de TRC, sendo que considerando a inacessibilidade de cateterizar outra veia tributária do seio coronário optou‐se por implantar eletrocateter epicárdico em localização lateral no VE (Figura 4). Não se levou a cabo, como alternativa, o reposicionamento do eletrocateter ventricular direito para uma posição septal, uma vez que antes da implantação do dispositivo de ressincronização os segmentos cuja ativação era mais tardia eram os da parede lateral, porque a distância entre os elétrodos não iria aumentar significativamente com esta manobra e porque para que pudesse ser iniciado pacing através de eletrocateter ventricular esquerdo era necessário implantá‐lo numa posição menos arritmogénica.
Através de toracotomia inframamária esquerda foi feita a implantação de sonda epicárdica posicionada entre a 2.a e 3.a artérias obtusas marginais.
Após um mês, a doente mantinha‐se em classe funcional III da NYHA, com má função sistólica global. A percentagem de pacing no VE era de 89% e a de pacing ventricular direito de 13%. As baixas percentagens de pacing Biv justificavam‐se pelas frequências intrínsecas rápidas em consequência da fibrilhação auricular. No entanto, não se verificou a ocorrência de qualquer tipo de arritmia ventricular na monitorização realizada pelo device.
Desta forma, procedeu‐se à otimização da terapêutica farmacológica para controlo da frequência ventricular intrínseca, com adição de digoxina ao esquema terapêutico, e aumento da frequência mínima de estimulação para 80bpm, e foi integrada num programa de reabilitação cardíaca. Optou‐se, numa primeira fase da estratégia de maximização da percentagem de pacing biventricular, por uma abordagem conservadora, com otimização da terapêutica farmacológica e reprogramação do dispositivo, em face do risco, teoricamente maior, de perda de captura no eletrocateter epicárdico relativamente às situações em que o posicionamento é feito no interior da rede tributária do seio coronário. No entanto, caso se verificasse insucesso desta estratégia, optar‐se‐ia pela ablação do nódulo auriculoventricular. Da mesma forma, se o eletrocateter ventricular esquerdo estivesse no interior do sistema venoso cardíaco, considerar‐se‐ia mais apropriada a realização da ablação nodal como primeira opção.
Aos seis meses pós‐implantação do eletrocateter ventricular esquerdo em posição epicárdica e após aumento da percentagem de pacing biventricular a doente mantinha‐se em classe III da NYHA, mas referindo ligeira melhoria sintomática na realização das tarefas diárias. A fração de ejeção subira para 19%. Não se registaram novos episódios de descompensação de insuficiência cardíaca, nem arritmias ventriculares na monitorização remota até esse período.
DiscussãoOs relatos iniciais sobre o efeito da TRC na incidência de eventos arrítmicos ventriculares referem haver um efeito antiarrítmico9,10, tendo como potenciais explicações a redução do stress parietal provocado pela remodelagem inversa induzida pelo pacing Biv, a menor dispersão da repolarização como resultado de duas ondas de despolarização diferentes11,12 e a diminuição da atividade do sistema nervoso simpático13.
Vários estudos sugeriram um efeito antiarrítmico decorrente da TRC com diminuição do número de extrassístoles ventriculares12, do número de eventos taquiarrítmicos14 e da indutibilidade de TV mantida15. Análises mais recentes sugerem que o efeito antiarrítmico é sobretudo observável em doentes em que ocorre ressincronização efetiva após TRC, isto é, nos respondedores, o que é visto como consequência do contributo benéfico da melhoria hemodinâmica promovida pelo pacing Biv16,17, mas não nos não respondedores.
Na última década, as indicações para TRC expandiram‐se e o estudo das suas consequências tornou‐se mais intenso, mas apesar disso os efeitos eletrofisiológicos desta modalidade de estimulação sobre a incidência de morte súbita e de arritmias ventriculares permanece pouco compreendido.
Têm sido descritos casos de aumento da incidência de eventos arrítmicos com introdução de pacing Biv em alguns doentes18‐20. Shukla et al.18 descreveram, em 2005, uma série de 145 doentes consecutivos, na qual cinco deles desenvolveram tempestades arrítmicas após implantação de TRC‐D, resolvidas permanentemente com descontinuação do pacing no VE. Da mesma forma, Medina‐Ravell et al.19 descreveram outra série de 29 doentes que receberam TRC‐D, em que quatro deles iniciaram extrassistolia ventricular com pacing biventricular, que era abolida com o abandono do pacing no VE. O mesmo fenómeno aconteceu com a doente do caso clínico descrito.
Corroborando com estas evidências, nos dois maiores ensaios clínicos aleatorizados que avaliaram os efeitos da TRC em doentes com e sem CDI, e onde houve benefício na mortalidade total relativamente à TMO – COMPANION 4 e CARE‐HF 5 – a percentagem de morte súbita entre as causas de morte foi ligeiramente maior21.
Assim, no estudo COMPANION houve uma redução de 36% (estatisticamente significativa: p=0,003) no grupo de doentes submetido a TRC e TMO, comparativamente ao grupo de doentes submetido unicamente a TMO. No entanto, a incidência de morte súbita foi maior nos doentes submetidos a TRC‐P+TMO versus doentes só com TMO (7,8 versus 5,8%). Simultaneamente, no grupo com TRC com desfibrilhador em back‐up (TRC‐D+TMO) a incidência de morte súbita foi de apenas 2,9%. Entre as causas de morte nos dois grupos, a morte súbita foi responsável por 36,6% dos casos no grupo com TRC‐P+TMO, 23,4% no grupo só com TMO e apenas 16,5% no grupo com TRC‐D+TMO.
No estudo CARE‐HF, apesar da diminuição da mortalidade observada num grupo de doentes submetidos a TRC em comparação com doentes submetidos unicamente a TMO, a incidência de morte súbita entre as causas de morte foi mais elevada nos primeiros (35,4 versus 31,7%).
Evidência contraditória foi obtida mais recentemente, no estudo REVERSE, que avaliou a incidência de episódios de TV/FV e TV mantida entre um grupo de doentes portadores de TRC‐D com pacing biventricular esquerdo ativado e outro grupo de portadores de TRC‐D, mas sem pacing biventricular ativado. Ao fim de dois anos de follow‐up, a incidência de eventos arrítmicos foi semelhante nos dois grupos (18,7 versus 21,9%, p=0,84)22.
Na sequência normal de ativação do miocárdio, o endocárdio é despolarizado primeiro do que as camadas mais epicárdicas, sendo a repolarização efetuada no sentido inverso: (epicárdio → endocárdio). O pacing Biv é normalmente efetuado através de um eletrocateter endocárdico colocado no ventrículo direito e de um eletrocateter colocado no interior do seio coronário ou numa das suas veias tributárias, o que resulta na estimulação do miocárdio ventricular esquerdo a partir do epicárdio. O pacing epicárdico promove uma sequência de ativação não fisiológica, com inversão do vetor de propagação transmural do impulso, e resultante atraso da despolarização do endocárdio com maior precocidade da repolarização do epicárdio23. Estudos experimentais demonstraram que o tempo de condução epicárdio‐endocárdio é significativamente maior do que o tempo de condução endocárdio‐epicárdio, devido a uma zona da parede miocárdica entre o subepicárdio profundo e as camadas mesomiocárdicas24,25. O aumento da dispersão da repolarização daí resultante traduz‐se pelo aumento dos intervalos QT, JT e entre o pico e o final da onda T24,26.
Neste contexto, num pequeno grupo de doentes predispostos pode ocorrer aumento da incidência de fenómenos de reentrada. Adicionalmente, a presença de miocardiopatia, a utilização de fármacos que prolonguem o QT e a própria desregulação autonómica podem contribuir para facilitar a ocorrência desses fenómenos27,28.
A identificação de fatores preditores de propensão à ocorrência de arritmias ventriculares mediadas pelo pacing Biv reveste‐se de relevância clínica na avaliação de doentes candidatos a este tipo de estimulação e na decisão de implantação de sistemas com desfibrilhador.
Os preditores de pró‐arritmia neste contexto ainda não estão totalmente identificados. A variação da dispersão do QT entre o período pré e pós‐implantação constitui uma variável que demonstrou ter poder preditor independente num estudo recente que incluiu 75 doentes submetidos a TRC, onde se observou que, após a implantação, havia um grupo no qual a dispersão do QT aumentava, com incidência de eventos arrítmicos major de 29%, e outro no qual a dispersão do QT diminuía, onde a incidência desses eventos foi de 3% (p=0,0017), num follow‐up de 807 dias29.
O mesmo estudo29 avaliou o valor da diferença temporal entre o pico da onda T (T‐pico) e o final desta onda (T‐final), outro marcador de dispersão da repolarização, tendo‐se concluído que os doentes que sofreram eventos arrítmicos no follow‐up tiveram uma redução significativamente mais discreta do período Tpico‐Tfinal do que os que ficaram livres de eventos (‐1,5±12,8ms versus ‐20,0±5,4ms, p=0,047).
Os mecanismos envolvidos na ocorrência desta resposta dicotómica da dispersão do QT após TRC ainda não estão estudados. Considera‐se que fatores como a presença de disfunção sistólica muito grave28, de alterações na perfusão30 ou a estimulação do miocárdio ventricular esquerdo a partir de zonas na proximidade de tecido fibrótico31possam concetualmente estar relacionadas com a modulação da dispersão do QT.
Tem sido reconhecido que a miocardiopatia dilatada se associa à presença de fibrose ventricular, alterações da arquitetura do tecido muscular e anomalias na ultraestrutura celular, nomeadamente nas suas membranas32,33, estando as propriedades eletrofisiológicas dos tecidos igualmente alteradas pela presença de zonas de bloqueio à condução resultantes de fibrose e zonas de condutibilidade e refratariedade alteradas34. A localização das regiões com alterações das propriedades eletrofisiológicas não é homogénea em todo o miocárdio com disfunção35. Mais ainda, os padrões de distribuição dessas zonas parecem diferir entre os doentes com miocardiopatia dilatada de causa isquémica e de causa não isquémica35, sendo que nos segundos ocorre envolvimento mais difuso, com predomínio nos segmentos basais e com menor atingimento do endocárdio, comparativamente aos doentes isquémicos, em que essas regiões estão mais restritas a determinados territórios arteriais e afetam tipicamente em maior extensão o endocárdio36,37. No caso apresentado, para além do profundo compromisso da função sistólica global, a doente sofrera de patologia valvular grave e tivera já sido submetida a cirurgia de substituição mitral, factos que podem ter modificado a arquitetura tecidular e consequentemente a distribuição das zonas com propriedades eletrofisiológicas alteradas.
Perante a suspeita de pró‐arritmia mediada pela pacing biventricular, a procura de locais alternativos para estimulação ventricular esquerda pode resultar na diminuição da arritmogenicidade. No caso apresentado, esse local alternativo, dada a ausência de opções, foi procurado com recurso a uma abordagem cirúrgica com toracotomia, na qual se realizaram testes de limiar em locais diferentes do epicárdio e foi avaliada a indução de extrassistolia ventricular pelo pacing Biv.
Têm sido tentadas algumas estratégias para contrariar o potencial risco arrítmico da estimulação ventricular esquerda através de tributárias do seio coronário. O pacing endocárdico ventricular esquerdo com eletrocateter colocado através de punção transseptal é uma delas, sendo um procedimento ainda em fase precoce de avaliação com resultados iniciais prometedores38,39.
A avaliação de parâmetros de heterogeneidade da repolarização durante a implantação é considerada uma opção pouco viável tendo em conta o facto de ainda não ter sido demonstrada, neste contexto, uma correlação clínica entre a alteração dos parâmetros de dispersão da repolarização e eventos adversos, e pelo facto de essa potencial arritmogenicidade poder apenas manifestar‐se horas ou dias após a implantação40.
ConclusãoA TRC não é isenta de efeitos adversos. Apesar de os benefícios suplantarem largamente os riscos na população com indicação para essa modalidade de estimulação, em casos raros pode ocorrer aumento da arritmogenicidade com a introdução do pacing Biv.
A inversão da sequência de despolarização fisiológica promove o aumento da dispersão da repolarização, o que facilita fenómenos de reentrada, que podem favorecer o aumento da incidência de arritmias ventriculares em determinados doentes.
Apesar do aumento paradoxal da arritmogenicidade com a TRC ser raro, pode gerar manifestações clínicas graves que exigem soluções que a simples reprogramação pode não resolver. No caso apresentado, apenas a remoção do pacing no seio coronário permitiu abolir a ocorrência de arritmias ventriculares. Perante a necessidade de ressincronização ventricular, um local alternativo para implantação do eletrocateter ventricular esquerdo teve de ser procurado, tendo‐se optado por uma abordagem epicárdica.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes e que todos os pacientes incluídos no estudo receberam informações suficientes e deram o seu consentimento informado por escrito para participar nesse estudo.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram não haver conflito de interesses.