O cancro cutâneo não melanoma é a neoplasia mais prevalente na população caucasiana e a sua incidência está a crescer. Nos últimos anos, um conjunto de estudos sugeriu que a terapêutica anti‐hipertensora poderá aumentar o risco destes tumores, salientando‐se a hidroclorotiazida, pelas suas propriedades fotossensibilizadoras. A crescente evidência disponível levou a Infarmed (Autoridade Nacional do Medicamento e Produtos de Saúde) a realizar um alerta dirigido aos profissionais de saúde para o risco de cancro cutâneo não melanoma com a exposição dos doentes a doses cumulativas deste fármaco. Contudo, os resultados dos estudos têm‐se revelado heterogéneos e, por vezes, contraditórios. A elevada incidência de cancro cutâneo não melanoma e o grande número de indivíduos a cumprir terapêutica crónica com hidroclorotiazida poderão ter importantes repercussões em termos de saúde pública. Neste artigo, os autores propuseram‐se a reunir e analisar a evidência científica disponível, tendo concluído uma possível associação entre a toma de hidroclorotiazida e o risco de cancro cutâneo não melanoma, não esquecendo, no entanto, algumas limitações dos trabalhos existentes na literatura. O reforço de medidas educacionais para a adoção de estratégias preventivas face à exposição solar, a monitorização regular da pele e avaliação individual do benefício da terapêutica com hidroclorotiazida são importantes, em particular na presença de antecedentes pessoais de tumores de pele.
Non‐melanoma skin cancer is the most prevalent malignancy in fair‐skinned people and its incidence is increasing. Recently, studies have suggested that antihypertensive drugs may increase the risk of these tumors, particularly hydrochlorothiazide, due to its photosensitizing properties. The Portuguese National Authority for Medicines and Health Products, INFARMED, has issued an alert to healthcare professionals concerning the increased risk of non‐melanoma skin cancer in patients exposed to cumulative doses of this drug. However, study results have been heterogeneous and sometimes conflicting. The high incidence of non‐melanoma skin cancer and the large number of patients under chronic hydrochlorothiazide therapy may thus have important public health consequences. In this article, the authors review the published evidence and conclude that there may be an association between hydrochlorothiazide use and the risk of non‐melanoma skin cancer, but also point out some limitations of the studies in the literature. It is important to promote preventive strategies against sun exposure, regular skin examinations, and individual assessment of the benefits of hydrochlorothiazide use, particularly in patients with previous skin cancer.
O cancro cutâneo não melanoma (CCNM) corresponde ao grupo de neoplasias malignas da pele compreendido pelo carcinoma basocelular (CBC) e o carcinoma espinocelular (CEC). O CCNM é a neoplasia mais prevalente na população caucasiana e a sua incidência na Europa e na América do Norte está a crescer1–3. Portugal não é exceção, observando‐se um crescimento do número de CCNM diagnosticados4,5.
O CBC e o CEC são neoplasias malignas da pele localmente invasivas, que com frequência atingem áreas nobres da face, como as pálpebras, exigindo terapêuticas complexas e altamente diferenciadas. Apesar do seu baixo potencial metastático, o CCNM está associado a morbilidade significativa, nomeadamente pela elevada taxa de recorrência de cancro cutâneo6.
A crescente incidência do CCNM impõe desafios importantes aos sistemas de saúde, com necessidade de adaptar os orçamentos ao significativo aumento da demanda pelos recursos destinados ao diagnóstico, terapêutica e seguimento destas neoplasias7.
O CBC e o CEC são entidades clínicas distintas, mas que compartilham um conjunto de fatores de risco, nos quais se salienta a exposição à radiação ultravioleta (UV), tendencialmente crónica e cumulativa no CEC e intensa e periódica no BCC, um fototipo baixo (Fitzpatrick I‐II), atividades laborais e/ou de lazer ao ar livre, exposição à luz UV artificial, com finalidade cosmética ou terapêutica, e terapêutica com fármacos imunossupressores, conforme demonstrado pela elevada incidência destes tumores em doentes com transplante de órgão sólido8,9.
Na última década, os esforços para identificar fatores de risco adicionais colocaram em evidência um conjunto de fármacos com propriedades fotossensibilizadoras, entre os quais anti‐hipertensores. Contudo, os estudos realizados geraram um conjunto de resultados heterogéneos e, por vezes contraditórios, limitando a generalização das conclusões obtidas.
Recentemente, um conjunto de trabalhos sugeriu uma forte associação entre a terapêutica com hidroclorotiazida (HCTZ) e o risco de CCNM10,11. A evidência disponível levou a Infarmed (Autoridade Nacional do Medicamento e Produtos de Saúde) a realizar um alerta para o risco de CCNM com a exposição dos doentes a doses cumulativas deste fármaco12.
Neste artigo, os autores procuraram reunir e analisar a evidência científica disponível que relaciona a terapêutica com HCTZ e o risco de CCNM.
Terapêutica com hidroclorotiazida e o risco de cancro cutâneo não melanomaEm Portugal, estima‐se que a prevalência da hipertensão arterial (HTA) na população adulta seja de 42,2%. Se considerada apenas a população idosa (com idade igual ou superior a 65 anos), os valores de prevalência são significativamente superiores, estimados em 74,9%13.
As guidelines de 2018da Sociedade Europeia de Cardiologia para o tratamento da HTA indicam os diuréticos tiazídicos como uma das cinco classes farmacológicas adequadas para o início da terapêutica, salientando a sua eficácia na redução da tensão arterial e, consequentemente, dos eventos cardiovasculares e da mortalidade14.
Recentemente, Pinto et al. identificaram os diuréticos tiazídicos, maioritariamente representados pela HCTZ, como a segunda classe de fármacos anti‐hipertensores mais escolhida para a terapêutica inicial da HTA nos cuidados de saúde primários, apenas superada pelos inibidores da enzima de conversão da angiotensina (IECA)15. De forma semelhante, o estudo VALSIM havia já demonstrado que a terapêutica diurética era a classe farmacológica mais utilizada neste nível de cuidados16.
O diagnóstico de HTA e o início da terapêutica faz‐se maioritariamente em indivíduos adultos de meia‐idade e assume com frequência um carácter prolongado, por vezes crónico. O aumento da esperança média de vida observado nas últimas décadas põe em evidência o elevado número de doentes expostos, que tomam HCTZ durante um extenso número de anos.
A HCTZ tem propriedades fotossensibilizadoras demonstradas e poderá ter um papel sinérgico com a radiação UV no processo de carcinogénese cutânea17. A fotossensibilidade pode ser definida como uma resposta anormal ou exagerada da pele à exposição à radiação UV ou à luz visível18. A HCTZ parece comportar‐se como um cromóforo que, após absorver radiação UVA, transfere energia para nucleótidos pirimidínicos adjacentes, induzindo a formação de dímeros potencialmente mutagénicos17.
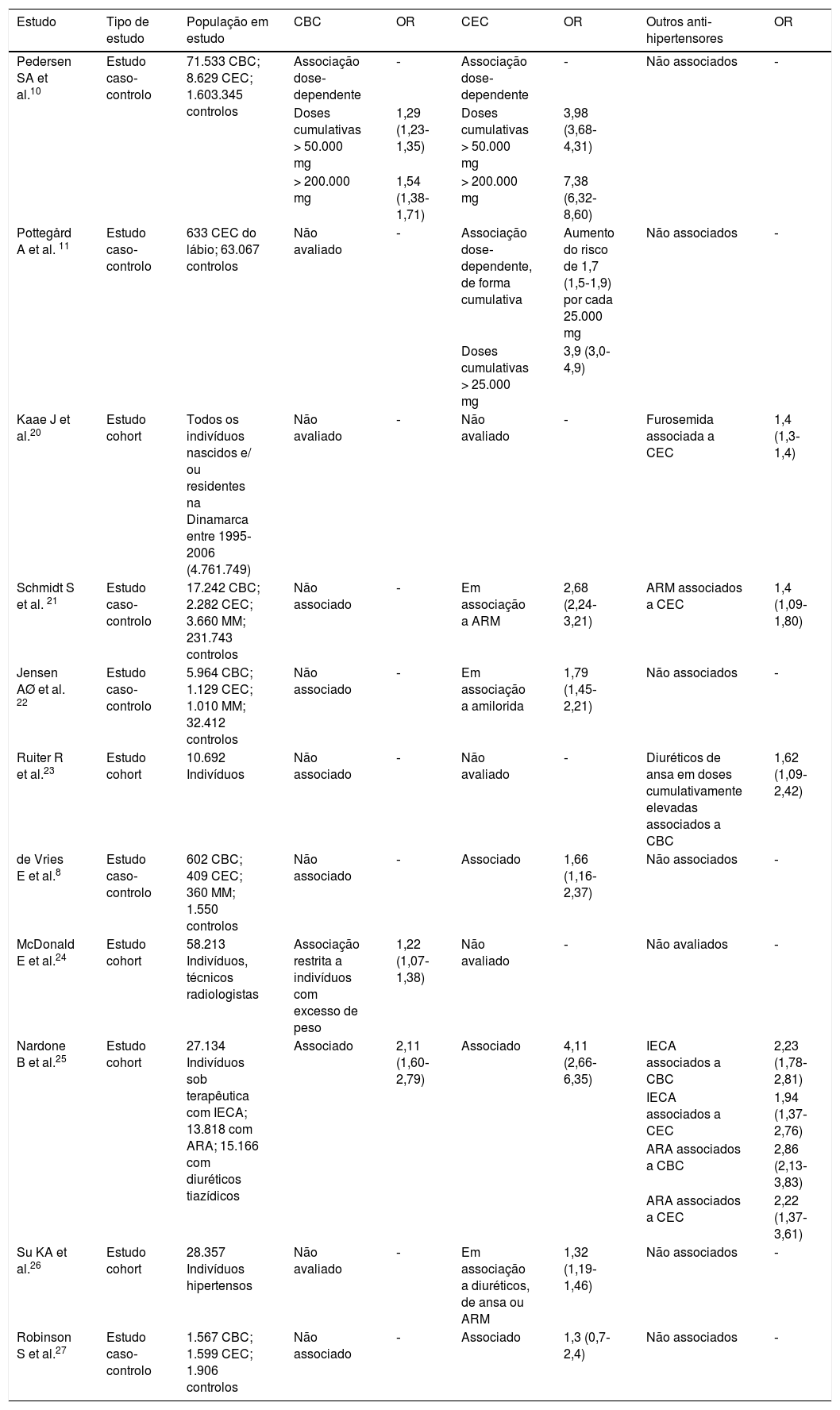
Na última década foi desenvolvido um conjunto de trabalhos que avaliaram a associação entre a terapêutica com HCTZ e o risco de CCNM. Na Tabela 1 são apresentados alguns dos seus elementos metodológicos e os seus principais resultados.
Estudos que avaliaram a associação da terapêutica com HCTZ e o risco de cancro de pele: principais resultados
| Estudo | Tipo de estudo | População em estudo | CBC | OR | CEC | OR | Outros anti‐hipertensores | OR |
|---|---|---|---|---|---|---|---|---|
| Pedersen SA et al.10 | Estudo caso‐controlo | 71.533 CBC; 8.629 CEC; 1.603.345 controlos | Associação dose‐dependente | ‐ | Associação dose‐dependente | ‐ | Não associados | ‐ |
| Doses cumulativas > 50.000 mg | 1,29 (1,23‐1,35) | Doses cumulativas > 50.000 mg | 3,98 (3,68‐4,31) | |||||
| > 200.000 mg | 1,54 (1,38‐1,71) | > 200.000 mg | 7,38 (6,32‐8,60) | |||||
| Pottegård A et al. 11 | Estudo caso‐controlo | 633 CEC do lábio; 63.067 controlos | Não avaliado | ‐ | Associação dose‐dependente, de forma cumulativa | Aumento do risco de 1,7 (1,5‐1,9) por cada 25.000 mg | Não associados | ‐ |
| Doses cumulativas > 25.000 mg | 3,9 (3,0‐4,9) | |||||||
| Kaae J et al.20 | Estudo cohort | Todos os indivíduos nascidos e/ ou residentes na Dinamarca entre 1995‐2006 (4.761.749) | Não avaliado | ‐ | Não avaliado | ‐ | Furosemida associada a CEC | 1,4 (1,3‐1,4) |
| Schmidt S et al. 21 | Estudo caso‐controlo | 17.242 CBC; 2.282 CEC; 3.660 MM; 231.743 controlos | Não associado | ‐ | Em associação a ARM | 2,68 (2,24‐3,21) | ARM associados a CEC | 1,4 (1,09‐1,80) |
| Jensen AØ et al. 22 | Estudo caso‐controlo | 5.964 CBC; 1.129 CEC; 1.010 MM; 32.412 controlos | Não associado | ‐ | Em associação a amilorida | 1,79 (1,45‐2,21) | Não associados | ‐ |
| Ruiter R et al.23 | Estudo cohort | 10.692 Indivíduos | Não associado | ‐ | Não avaliado | ‐ | Diuréticos de ansa em doses cumulativamente elevadas associados a CBC | 1,62 (1,09‐2,42) |
| de Vries E et al.8 | Estudo caso‐controlo | 602 CBC; 409 CEC; 360 MM; 1.550 controlos | Não associado | ‐ | Associado | 1,66 (1,16‐2,37) | Não associados | ‐ |
| McDonald E et al.24 | Estudo cohort | 58.213 Indivíduos, técnicos radiologistas | Associação restrita a indivíduos com excesso de peso | 1,22 (1,07‐1,38) | Não avaliado | ‐ | Não avaliados | ‐ |
| Nardone B et al.25 | Estudo cohort | 27.134 Indivíduos sob terapêutica com IECA; 13.818 com ARA; 15.166 com diuréticos tiazídicos | Associado | 2,11 (1,60‐2,79) | Associado | 4,11 (2,66‐6,35) | IECA associados a CBC | 2,23 (1,78‐2,81) |
| IECA associados a CEC | 1,94 (1,37‐2,76) | |||||||
| ARA associados a CBC | 2,86 (2,13‐3,83) | |||||||
| ARA associados a CEC | 2,22 (1,37‐3,61) | |||||||
| Su KA et al.26 | Estudo cohort | 28.357 Indivíduos hipertensos | Não avaliado | ‐ | Em associação a diuréticos, de ansa ou ARM | 1,32 (1,19‐1,46) | Não associados | ‐ |
| Robinson S et al.27 | Estudo caso‐controlo | 1.567 CBC; 1.599 CEC; 1.906 controlos | Não associado | ‐ | Associado | 1,3 (0,7‐2,4) | Não associados | ‐ |
ARA: antagonista do recetor da angiotensina II; ARM: antagonista do recetor de mineralocorticoides; CBC: carcinoma basocelular; CCNM: cancro cutâneo não melanoma; CEC: carcinoma espinocelular; HCTZ: hidroclorotiazida; IECA: inibidor da enzima de conversão da angiotensina; OR: odds ratio.
A crescente evidência reunida levou a Infarmed, em articulação com a Agência Europeia do Medicamento (EMA), a efetuar uma comunicação dirigida aos profissionais de saúde, datada de 10 de outubro, de 2018, na qual recomenda aos médicos que informem os doentes tratados com HCTZ:
- 1.
Do risco potencial de cancro da pele;
- 2.
Da necessidade de uma vigilância regular da sua pele;
- 3.
Da necessidade de evitarem a exposição à luz solar e à radiação ultravioleta e, em caso de exposição, usarem proteção adequada para minimizar o risco;
- 4.
Em doentes com antecedentes de cancro da pele, refere a comunicação, poderá ser necessário o médico reconsiderar cuidadosamente a utilização de HCTZ12.
Nesta comunicação são salientados dois estudos farmacoepidemiológicos realizados na Dinamarca e publicados no último ano, que evidenciam uma associação dose‐dependente, cumulativa, entre a HCTZ e o CCNM10,11. Estes estudos basearam‐se em bases de dados nacionais (incluindo o Danish Cancer Registry e o National Prescription Registry) e destacam‐se pelo rigor metodológico e pela dimensão da amostra.
O trabalho de Pedersen et al. incluiu uma população constituída por 80.162 indivíduos com o primeiro diagnóstico de CCNM (71.533 de CBC e 8.629 de CEC), emparelhada com um conjunto de casos‐controlo. Os indivíduos que cumpriam terapêutica com doses elevadas de HCTZ, isto é, cumulativamente superiores a 50.000mg, tinham uma taxa de probabilidade (OR – odds ratio) ajustada de 1,29 [intervalo de confiança (IC): 95%; 1,23‐1,35] para CBC e 3,98 (IC 95%; 3,68‐4,31) para CEC. Na presença de doses cumulativas muito elevadas de HCTZ (superiores a 200.000mg), verificou‐se uma taxa de probabilidade ajustada ainda maior, estimada em 1,54 (IC 95%; 1,38‐1,71) para o CBC e 7,38 para o CEC (IC 95%; 6,32‐8,60)10.
Num estudo publicado em 2017, Pottegård et al. avaliaram a relação entre a terapêutica com HCTZ e o risco de CEC do lábio. Para tal, emparelharam 633 indivíduos com o diagnóstico histológico desta neoplasia com uma amostra formada por 63.607 casos controlo. Foi observada uma associação significativa para utilizadores de doses elevados do fármaco, superiores a 25.000mg, com taxa de probabilidade de 3,9 (IC 95%; 3,0‐4,9). Verificou‐se ainda um claro incremento de risco com o aumento da dose cumulativa, estimado em 1,7 (IC 95%; 1,5‐1,9) por cada 25.000mg adicionalmente tomados11.
Também na Dinamarca, outros estudos que avaliaram a relação entre a terapêutica anti‐hipertensora e o risco de CCNM apresentaram resultados divergentes19–21. Nestes trabalhos, a associação entre a utilização de diuréticos tiazídicos e o aumento do risco de CCNM foi menos robusta e apenas se verificou em terapêuticas conjuntas com diuréticos antagonistas do recetor de mineralocorticoides (ARM). Em simultâneo, foram identificados outros fármacos anti‐hipertensores que se associaram a um risco aumentado de CCNM, nomeadamente a furosemida, que no estudo de Kaae et al. esteve significativamente associada ao risco de CEC19.
Na Europa, com exceção dos estudos realizados na Dinamarca, poucos trabalhos avaliaram a associação entre a terapêutica com HCTZ e o risco de CCNM8,22. Num estudo cohort realizado na Holanda, apenas se verificou uma relação estatisticamente significativa entre a terapêutica com diuréticos de ansa em doses cumulativamente elevadas e o risco de CBC22. Em contraste, num outro estudo caso‐controlo multicêntrico, que envolveu múltiplos países europeus, foi identificada uma associação entre a terapêutica com diuréticos tiazídicos e o risco de CEC8.
Os estudos realizados nos Estados Unidos da América parecem demonstrar uma associação entre a terapêutica com diuréticos tiazídicos e o risco de CCNM, embora os seus resultados sejam heterogéneos e, por vezes, contraditórios23–26. McDonald E et al. e Nardone B et al. identificaram um aumento do risco de CBC, restrito aos indivíduos com excesso de peso no caso do primeiro23,24. Por seu turno, Nardone B et al., Su KA et al. e Robinson S et al. reportaram uma associação entre estes fármacos e o risco de CEC24–26. À semelhança dos estudos realizados em território europeu, foram também identificadas associações com outros anti‐hipertensores. No trabalho de Su et al., as terapêuticas que bloqueiam o eixo renina‐angiotensina‐aldosterona, quer os IECA, quer os antagonistas do recetor da aldosterona (ARA), estiveram associadas a um aumento do risco de ambos os tipos histológicos de CCNM25.
Recentemente, foram publicadas duas meta‐análises, cujo objetivo foi avaliar uma possível associação entre a terapêutica anti‐hipertensora e o risco de cancro cutâneo27,28. Numa meta‐análise de 19 estudos independentes, Gandini et al. não encontraram evidência de associação entre o uso de diuréticos tiazídicos e o CCNM. Diferentemente, esta associação foi encontrada com os bloqueadores dos canais de cálcio (BCC), em que se verificou um risco aumentado de cancro cutâneo, sem diferenciação de subtipo (OR 1,14; IC 95%; 1,07‐1,21) e com os beta‐bloqueadores, neste caso limitada ao melanoma maligno (MM) (OR 1,21; IC 95%; 1,05‐1,40)27. Contrastando com os resultados anteriormente apresentados, Tang et al., numa meta‐análise que avaliou 10 estudos independentes, identificaram uma associação estatisticamente significativa entre a terapêutica diurética e o risco de CCNM, com maior taxa de probabilidade para o CEC (OR 1,40; IC 95%; 1,19‐1,66) do que para o CBC (OR 1,10; IC 95%, 1,01‐1,20). Verificou‐se também que o risco de CBC esteve associado à toma de BCC (OR 1,15; I 95%; 1,09‐1,21) e de beta‐bloqueantes (OR 1,09; IC 95%; 1,04‐1,15)28.
Recentemente, Pottegård et al. realizaram um trabalho com o objetivo de identificar uma associação entre a terapêutica com HCTZ e o risco de MM, tendo‐se verificado uma taxa de probabilidade liminarmente elevada (OR 1,22; IC 95%; 1,09‐1,36), sem incremento com doses cumulativas crescentes do fármaco29. De forma semelhante, Nardone B et al. demonstraram uma relação estatisticamente significativa entre a terapêutica com diuréticos tiazídicos e esta neoplasia (OR 1,82; IC 95%; 1,01‐3,82)24. Previamente, Schmidt et al. e Jensen et al. haviam reportado um aumento do risco de MM com os ARA (OR 1,44; IC 95%; 0,56‐3,69) e a indapamida (OR 3,30; IC 95%; 1,34‐8,10), respetivamente20,21.
DiscussãoNa última década, assistimos a um interesse crescente pelo potencial papel da terapêutica anti‐hipertensora, em particular dos fármacos diuréticos, no risco de CCNM. Na sequência do recente alerta emitido pelo Infarmed procurámos reunir a evidência científica disponível que relaciona a toma de HCTZ ao risco aumentado destas neoplasias cutâneas.
Na análise dos resultados dos estudos realizados, verificámos existir um conjunto de dados que sugerem uma associação entre a terapêutica com HCTZ e o risco de CEC e, em menor grau, de CBC. Os trabalhos farmacoepidemiológicos realizados na Dinamarca e recentemente publicados demonstraram que esta relação parece ser dose‐dependente, de forma cumulativa10,11. A evidência da associação entre este fármaco e o risco de CCNM havia já sido sugerida em outros trabalhos realizados na Europa e nos Estados Unidos da América, sendo de forma transversal mais sólida a associação com o CEC do que com o CBC. Contudo, importa salientar alguma heterogeneidade entre os resultados obtidos, que poderá em parte ser explicada por diferenças metodológicas e nas características da população em estudo. Na pesquisa que efetuámos, encontrámos referências a um potencial papel de outras classes farmacológicas de anti‐hipertensores, nomeadamente diuréticos não tiazídicos, BCC, beta‐bloqueantes e inibidores do eixo renina‐angiotensina‐aldosterona. Contudo, é importante salientar que em muitos países, entre os quais a Dinamarca, a HCTZ é comercializada quase exclusivamente em associação a outros anti‐hipertensores, entre os quais os diuréticos ARM11. Simultaneamente, sabe‐se que apenas é possível controlar de forma eficaz os valores de tensão arterial com recurso a monoterapia numa fração reduzida de doentes, pelo que a avaliação do papel individual de cada fármaco é muitas vezes difícil14. A evidência sobre a implicação de outros anti‐hipertensores no risco de CCNM tem‐se revelado bastante heterogénea e dificilmente generalizável. O elevado número de indivíduos que cumpre terapêutica com estes fármacos releva a necessidade de estudos adicionais para clarificar, de forma rigorosa, eventuais associações e a magnitude das mesmas.
Apesar de não ser o objetivo primário deste trabalho, deparámo‐nos com um conjunto de dados que sugerem uma potencial associação entre a terapêutica anti‐hipertensora e o risco de MM. Assistimos com particular interesse aos resultados do trabalho de Pottegård et al., que colocou em evidência a pertinência de eventuais investigações futuras com o objetivo de esclarecer o papel de terapêuticas fotossensibilizadoras como a HCTZ no seu processo de carcinogénese29.
Os desenhos metodológicos dos diversos estudos que avaliaram uma possível associação entre a terapêutica com HCTZ e o risco de CCNM apresentam algumas limitações. Em alguns trabalhos não é possível excluir com segurança a influência de alguns fatores confundidores, não controlados, nos seus resultados.
O papel da radiação UV na promoção da fotocarcinogénese e a influência do fototipo do indivíduo no risco de neoplasia cutânea estão bem documentados8. Numa fração importante dos estudos, nomeadamente nos realizados em território dinamarquês, não foi possível avaliar os hábitos de exposição solar, a existência de atividades laborais ou de lazer ao ar livre e a história pregressa de queimadura solar10,11,19–21,24,26. Simultaneamente, a avaliação do fototipo e de outras características fenotípicas apenas foi efetuada num pequeno número dos estudos apresentados8,22,23. A evidência que relaciona a terapêutica com HCTZ e o risco de CCNM tem origem, maioritariamente, em estudos realizados em países com baixos índices de radiação UV, como a Dinamarca, não existindo qualquer estudo em regiões com elevados índices de radiação UV.
Uma significativa porção dos trabalhos referidos neste artigo recorreu à consulta de bases de dados para a obtenção de informação sobre as características demográficas, as comorbilidades e os diagnósticos de cancro cutâneo. A robustez metodológica e o elevado grau de evidência obtido nos estudos realizados na Dinamarca resultam, também, da qualidade dos seus sistemas de registo de dados, que permitem a inclusão de um elevado número de doentes, com informação fidedigna. A divergência entre os resultados dos trabalhos realizados na Dinamarca e em outros países, nomeadamente os Estados Unidos da América, poderá ter origem na diferente forma de obtenção dos dados. Contudo, não é possível excluir outros elementos, nomeadamente a influência do património genético e de fatores ambientais distintos, como os hábitos de exposição solar, não avaliados em grande parte dos estudos24.
Os dados relativos à terapêutica anti‐hipertensora foram na maioria dos estudos obtidos a partir da consulta de registos informáticos de prescrição e de dispensa dos fármacos ou com recurso a questionários. O recurso a dados eletrónicos é uma potencial fonte de viés, na medida em que é impossível garantir a adesão terapêutica.
A HCTZ parece contribuir para o processo de carcinogénese cutânea através do seu papel fotossensibilizador, sendo expectável que a sua influência no aumento da incidência de CCNM se manifeste após um período de latência variável17,22. A avaliação da posologia e da duração da terapêutica com HCTZ é fundamental para clarificar a sua associação ao CCNM, ma em alguns estudos referidos neste artigo não foi possível obter as referidas informações e em outros a qualidade dos dados limitou a obtenção de conclusões sobre a influência da dose8,21,24. Salientamos ainda que a duração do seguimento poderá ter subestimado a incidência de CCNM em alguns trabalhos, dado o elevado tempo de latência entre o início da terapêutica com HCTZ e o desenvolvimento de neoplasia cutânea em alguns indivíduos.
O risco de CCNM está aumentado num conjunto de patologias, entre as quais a diabetes mellitus, a infeção pelo vírus da imunodeficiência humana, após uma neoplasia e após transplante de órgão sólido30–32. Em alguns dos trabalhos referidos não foi possível excluir a influência destas comorbilidades nos resultados obtidos8,19,22,23,25,26.
A HCTZ parece ter um impacto mais significativo no risco de CEC, sugerindo que a sua influência ocorre em associação com um dano para pele tendencialmente cumulativo e crónico10,11. É expectável que estes indivíduos desenvolvam previamente dermatoses pré‐malignas, nomeadamente queratose actínica, mas este elemento não foi avaliado na maioria dos estudos realizados.
O seguimento regular pelo seu médico nos indivíduos com o diagnóstico de HTA, em particular nos cuidados de saúde primários, poderá justificar uma vigilância mais rigorosa, aumentando a probabilidade de diagnóstico de CCNM.28 Contudo, este fator de viés parece menos plausível, dada a heterogeneidade entre as associações das diferentes terapêuticas anti‐hipertensoras e o risco de neoplasia cutânea.
A elevada prevalência da utilização de HCTZ contribuiu para a redução da mortalidade atribuível a patologia do foro cardiovascular a que temos assistido nas últimas décadas33,34. Os alertas dirigidos à prescrição deste fármaco devem ser cautelosos, considerando potenciais riscos resultantes de um alarme junto dos profissionais de saúde e, inevitavelmente, dos doentes, com prejuízo na adesão à terapêutica e no controlo tensional.
Em doentes com elevado risco de cancro de pele, em particular indivíduos com antecedentes de neoplasia cutânea, é importante considerar potenciais alternativas terapêuticas no tratamento da HTA.
ConclusãoA elevada incidência de CCNM e o grande número de indivíduos a cumprir terapêutica crónica com HCTZ poderá ter importantes repercussões em termos de saúde pública. O reportado aumento do risco desta neoplasia, mesmo que modesto, pode traduzir‐se num elevado número de doentes diagnosticados, com significativas implicações clínicas e económicas.
O alerta emitido pela Infarmed reconhece a necessidade de avaliar individualmente o benefício da terapêutica com HCTZ, em particular na presença de antecedentes de cancro de pele. O reforço de medidas educacionais, como a evicção da exposição à luz solar entre as 11h e as 16h e a promoção de estratégias preventivas como a utilização de vestuário adequado, chapéu e de protetor solar, tem nestes doentes particular relevo. No seguimento dos indivíduos que cumprem terapêutica com HCTZ é muito importante a monitorização regular, com avaliação de potenciais lesões cutâneas suspeitas e referenciação precoce à especialidade de dermatologia.
Este artigo confirma uma possível associação entre a toma de HCTZ e o risco de CCNM, mas também algumas limitações dos trabalhos existentes na literatura. Parece‐nos serem necessários mais estudos com um desenho metodológico robusto, prospetivos e que controlem potenciais fatores de risco, como a exposição solar e o fototipo, de forma a identificar a verdadeira magnitude das relações entre a terapêutica anti‐hipertensora e o cancro cutâneo.
Conflitos de interesseOs autores não têm qualquer conflito de interesse.