O encerramento percutâneo do apêndice auricular esquerdo (AAE) constitui uma terapêutica de interesse clínico nos doentes de alto risco de acidente vascular cerebral (AVC) e contraindicação para anticoagulação oral (ACO). A ecografia intracardíaca (ICE) pode tornar este procedimento exequível em doentes em que o ecocardiograma transesofágico (ETE) está desaconselhado. Os objetivos consistiram na avaliação da eficácia e segurança da técnica de encerramento do AAE e na avaliação da exequibilidade do ICE em comparação com o ETE para guiar o procedimento.
MétodosEstudo de coorte em doentes submetidos a encerramento do AAE entre maio 2010 e janeiro 2017. Realizada uma avaliação clínica e imagiológica antes e após o procedimento.
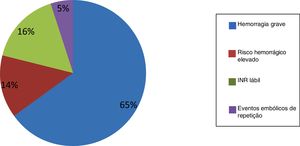
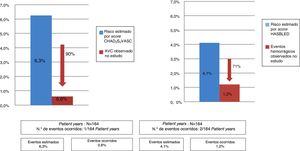
Resultados82 doentes (idade 74±8 anos, 64,4% homens) em que a razão para não realizar ACO foi: hemorragia grave/anemia não controladas (65%), risco hemorrágico elevado (14%), INR lábil (16%) e eventos embólicos de repetição apesar de ACO terapêutica (5%). O procedimento foi guiado por ETE ou ICE. A taxa de sucesso de implantação de dispositivo foi de 96,3%. Foram comparadas as duas técnicas de imagem não se tendo verificado diferenças estatisticamente significativas. No seguimento houve um AVC isquémico, duas complicações hemorrágicas, quatro mortes de causa não cardiovascular. Os eventos embólicos e hemorrágicos foram menos frequentes do que o esperado de acordo com os scores CHA2DS2VASc (0,6% versus 6,3%, p<0,001) e HASBLED (1,2% versus 4,1%, p<0,001).
ConclusõesNesta amostra, o encerramento percutâneo do AAE foi considerado seguro e eficaz comparativamente aos eventos estimados pelo CHA2DS2VASc e HASBLED. Os procedimentos guiados por ICE na aurícula esquerda não tiveram resultados clínicos ou imagiológicos inferiores aos procedimentos conduzidos por ETE.
Percutaneous closure of the left atrial appendage (LAA) is a promising therapy in patients with atrial fibrillation with high risk for stroke and contraindication for oral anticoagulation (OAC). Intracardiac echocardiography (ICE) may make this percutaneous procedure feasible in patients in whom transesophageal echocardiography (TEE) is inadvisable. Our aim was to assess the efficacy and safety of LAA closure and the feasibility of ICE compared to TEE to guide the procedure.
MethodsIn this cohort study of patients who underwent LAA closure between May 2010 and January 2017, clinical and imaging assessment was performed before and after the procedure.
ResultsIn 82 patients (mean age 74±8 years, 64.4% male) the contraindications for OAC were severe bleeding or anemia (65%), high bleeding risk (14%), labile INR (16%), or recurrent embolic events (5%). The procedural success rate was 96.3%. The procedure was guided by TEE or ICE, and no statistically significant differences were observed between the two techniques. During follow‐up, one patient had an ischemic stroke at 12 months, two had bleeding complications at six months, and there were four non‐cardiovascular deaths. Embolic and bleeding events were less frequent than expected from the observed CHA2DS2VASc (0.6% vs. 6.3%; p<0.001) and HAS‐BLED (1.2% vs. 4.1%; p<0.001) risk scores.
ConclusionsIn this population percutaneous LAA closure was shown to be safe and effective given the lower frequency of events than estimated by the CHA2DS2VASc and HAS‐BLED scores. The clinical and imaging results of procedures guided by ICE in the left atrium were not inferior to those guided by TEE.
A fibrilhação auricular (FA) em Portugal tem uma prevalência de 2,5% em indivíduos >40 anos (FAMA)1, sendo mais prevalente em idosos, na hipertensão arterial, doença valvular, obesidade, diabetes mellitus ou doença renal crónica2.
A FA associa‐se a morbilidade e mortalidade elevadas, duplica de forma independente o risco de morte e aumenta, em cinco vezes, o risco de acidente vascular cerebral (AVC)2,3. O AVC embólico tem maior gravidade clínica quando comparado com outras causas de lesão cerebral, sendo frequentemente fatal ou condicionando maior incapacidade e taxa de recorrência2–6.
Apesar da eficácia da anticoagulação oral (ACO), a varfarina encontra‐se contraindicada em 14‐44% dos doentes em risco de AVC cardiomebólico7‐10. Mesmo nos considerados elegíveis, apenas 54% se encontram hipocoagulados10,11. Para tal, contribuem múltiplos fatores, sendo o risco de hemorragia o principal responsável pelo seu desuso. A par deste, a necessidade de monitorizações laboratoriais frequentes, de colaboração do doente e o próprio receio dos clínicos colocam em causa a exequibilidade deste tratamento4.
Mais recentemente surgiram os anticoagulantes seletivos: os inibidores diretos da trombina (dabigratano) e os inibidores do fator Xa (ribaroxabano, apixabano, edoxabano). O dabigratano (RE‐LY10), o rivaroxabano (ROCKET‐AF12), o apixabano (ARISTOTLE13) e o edoxabano (ENGAGE14) demonstraram a sua não inferioridade comparativamente com a varfarina na prevenção de eventos tromboembólicos na FA, e as recomendações de FA da Sociedade Europeia de Cardiologia, consideram os ACO seletivos preferenciais à varfarina2. Contudo estes fármacos apresentam um risco hemorrágico importante, o que constitui uma barreira à sua utilização em alguns doentes com acrescida morbilidade. A descontinuação terapêutica destes fármacos ocorreu maioritariamente por intolerância/efeitos adversos, que no ARISTOTLE13 correspondeu a 25,3% dos doentes sob apixabano (versus 27,5% para a varfarina), no ENGAGE14 a 34,4% dos doentes sob edoxabano (versus 34,5% para a varfarina) sendo mesmo superior à verificada para a varfarina nos estudos RE‐LY10 (21% para dabigratano versus 17%) e ROCKET‐AF12 (23,7% para rivaroxabano versus 22,2%). Além disso, todos estes fármacos estão desaconselhados no caso de antecedentes de AVC hemorrágico, hemorragia não cerebral não controlada ou doença renal crónica terminal/hemodiálise.
Na FA não valvular, a maioria dos trombos têm origem no apêndice auricular esquerdo (AAE)2. O encerramento percutâneo do AAE constitui uma estratégia terapêutica recomendada para os doentes com FA não valvular, alto risco de AVC2 e contraindicação para a ACO. A sua exequibilidade foi demonstrada em diversos estudos clínicos realizados com diferentes dispositivos4,11,15,16–22. Tendo em conta o carácter invasivo do encerramento percutâneo do AAE, os doentes que potencialmente apresentariam uma melhor relação risco‐benefício seriam aqueles com risco tromboembólico elevado e contraindicação ou falência da terapêutica anticoagulante16–22. O encerramento percutâneo do AAE foi já descrito em doentes com um regime de antiagregação plaquetária, sem necessidade de anticoagulação inicial após a implantação18–25.
O presente trabalho pretendeu avaliar a eficácia e a segurança do encerramento percutâneo do AAE para prevenção de AVC em doentes com FA não valvular e com falência ou contraindicação para ACO. O objetivo secundário foi a comparação dos procedimentos guiados por ICE com aqueles conduzidos por ETE, no apoio ao procedimento percutâneo.
MétodosSeleção de doentesEntre maio de 2010 e janeiro de 2017 foram selecionados para encerramento percutâneo do AAE, 82 doentes com FA não valvular (64,6% permanente, 4,9% persistente, 30,5% paroxística), com risco cardioembólico estimado por CHA2DS2VASC ≥ 2, sem condições para ACO por contraindicação ou falência da mesma na prevenção de eventos tromboembólicos. Todos os doentes assinaram consentimento informado.
Definiu‐se AVC como um comprometimento neurológico focal que ocorreu subitamente com sintomas, persistindo para além de 24 horas, ou levando à morte, com provável origem vascular (World Health Organization [WHO], 2006).
As complicações hemorrágicas foram definidas e classificadas de acordo com o sistema de classificação TIMI26. Assim, hemorragia major foi definida como ocorrência de hemorragia intracraniana ou perda de sangue associada a descida da hemoglobina ≥ 5g/dL; Hemorragia minor foi definida como perda de sangue associada a descida da hemoglobina ≥ 3 e < 5g/dL ou descida da hemoglobina ≥ 4g/dL sem perda de sangue clinicamente evidente. Hemorragia mínima foi definida como perda de sangue clinicamente evidente não associada a descida da hemoglobina ≥ 3g/dL.
A doença renal crónica foi definida com base na classificação de KDIGO 2012 em 5 estádios27.
Assumiu‐se que não estavam reunidas condições para ACO quando: 1) a terapêutica com varfarina ou outro ACO era inadequada dadas as comorbilidades do doente, 2) INR (international normalized ratio) lábil ou impossibilidade de monitorização, 3) presença de discrasia sanguínea secundária a doença hematológica, 4) antecedentes de hemorragia cerebral, de hemorragia não cerebral grave (não controlada sob ACO ou antiagregação plaquetária) e 5) ineficácia da ACO estabelecida pela identificação de trombo no AAE ou ocorrência de eventos tromboembólicos apesar de ACO adequada.
Protocolo do encerramento percutâneo de AAE e seguimentoPara caracterização da morfologia, medição da profundidade e diâmetros do AAE e exclusão de trombo todos os doentes realizaram ETE antes do procedimento, após preenchimento vascular com solução salina (500mL). As implantações foram guiadas por ETE tridimensional sob sedação profunda ou ICE sob anestesia local com a sonda localizada na aurícula esquerda.
Nos procedimentos guiados por ETE tridimensional foram realizadas as incidências standard (0°, 45°, 90° e 135°) para guiar o procedimento e reavaliar dimensões do AAE.
Nos casos guiados por ICE, foram usados dois acessos femorais ‐ à esquerda para introdução do ICE e à direita para realização do procedimento de encerramento de AAE. No início, o ICE era colocado na aurícula direita com rotação horária e tilt posterior para permitir a visualização da fossa ovalis e guiar a punção transseptal com orientação inferior e posterior. Posteriormente, a punção do septo interauricular era dilatada três vezes com a bainha de entrega do dispositivo, para facilitar a passagem do ICE para a AE através desta única punção transseptal. A seguir, a sonda de ICE era avançada com ligeiro tilt anterior para a AE, seguindo a guia (stiffwire) assente nas veias pulmonares. O ICE na AE era posicionado paralelamente ao AAE, com rotação horária e tilt posterior, adquirindo‐se três planos similares aos protocolados para o ETE: o plano mitral ‐ sem angulação da sonda de ICE (podendo corresponder ao plano 80‐120° do ETE), o plano aórtico ‐ tilt posterior da sonda de ICE (plano 0‐50° do ETE), e plano posterior ‐ tilt posterior extremo da sonda de ICE e sonda paralela à veia pulmonar superior esquerda (plano 110‐135° do ETE). O ICE foi utilizado sobretudo para guiar a punção transseptal, canulação da bainha de entrega no AAE, libertação controlada do dispositivo no AAE e avaliação da posição e dos marcadores de segurança antes da libertação final do dispositivo de encerramento no AAE.
Foram comparadas as duas técnicas em relação a taxa de sucesso de implantação de dispositivo, visualização bidimensional e Doppler, tempo de procedimento e fluoroscópico, complicações e duração da hospitalização. Foram utilizados dois tipos de dispositivo de encerramento de AAE: Amplatzer Cardiac Plug/Amulet (ACP; St. Jude Medical, Plymouth, Minnesota, Estados Unidos) ou WATCHMAN (Boston Scientific, Plymouth, Minnesota, Estados Unidos). O tamanho dos dispositivos foi selecionado com base nas medições ecocardiográficas obtidas por ETE e angiográficas do AAE (2 incidências: 20o esquerda com 20o cranial e 20o esquerda com 20o caudal). No caso dos procedimentos realizados por ICE, o tamanho dos dispositivos era selecionado tendo em conta as medições do ETE (do dia prévio), as medições angiográficas e aquelas adquiridas pelo ICE.
O protocolo terapêutico após o encerramento do AAE consistia na dupla antiagregação (aspirina 100mg id e clopidogrel 75mg id) durante um mês e antiagregação simples durante seis meses, podendo ser posteriormente descontinuados os antitrombóticos à descrição do médico assistente. Todos os doentes realizaram ecocardiograma transtorácico (ETT) no primeiro dia após encerramento para avaliação de derrame pericárdico, deslocamento ou migração do dispositivo ou fluxo peridispositivo. Após o primeiro mês do procedimento, foi realizado ETE para avaliação de sinais de endotelização incompleta (fluxo peridispositivo ≥ 3mm), formação de trombo aderente ao dispositivo, deslocamento ou migração do implante, ou sinais de compressão da veia pulmonar superior esquerda ou da artéria circunflexa, detetada por alterações da cinética segmentar da área irrigada.
Foi mantido seguimento clínico durante 23±1 meses com pesquisa de eventos adversos como morte ou ocorrência de AVC/AIT, e ecocardiográfico com recurso a ETT aos 3, 6, 9 e 12 meses do procedimento. No caso de complicações na avaliação ecocardiográfica, podiam ser agendados novos controlos com ETE à descrição do ecocardiografista.
O seguimento clínico e ecocardiográfico ficou completo, não se tendo perdido casos durante o follow‐up (coorte no final do seguimento = 82 doentes).
Análise estatísticaFoi realizada uma análise descritiva das variáveis numéricas, com cálculo do valor médio e desvio padrão, e variáveis categóricas que foram descritas quanto às frequências absolutas e relativas de cada categoria. As frequências relativas apresentam‐se expressas em percentagem, arredondadas às décimas. A análise estatística foi realizada com recurso ao software SPSS versão 20.0.
ResultadosCaracterização da populaçãoA população incluiu 82 doentes com antecedentes de FA não valvular, sendo 64,6% homens, com idade média 74±8,0 anos. Estes apresentaram um score de risco embólico CHA2DS2VASC médio de 4,7±1,4. O score hemorrágico HAS‐BLED foi 3,3±1,0, sendo ≥ 3 em 67,1% dos doentes. Antecedentes de AVC isquémico e hemorragia grave foram observados em 41,5% e 59,7% dos casos, respetivamente.
As principais características da população e as contraindicações para ACO encontram‐se representadas na Tabela 1 e Figura 1. A principal indicação para o encerramento de AAE foi a hemorragia major sob anticoagulação oral (63,0% sob varfarina e os restantes sob ACO seletivos). Outra importante indicação na nossa coorte foi o «INR lábil» que incluiu doentes com múltiplas hemorragias de sem relevo clínico (i.e equimose ou hematoma nos membros superiores e inferiores) associados à dificuldade de monitorização do INR, dificuldade em manter INR no intervalo terapêutico (INR 2.0‐3.5) em sucessivas medições (>50% dos controlos da consulta), impossibilidade/incapacidade do doente em manter controlo de INR regularmente (≥ 1x/mês), associado à insegurança do clínico em continuar a prescrição de varfarina. De salientar, que a maioria dos casos incluídos na categoria de «INR lábil», surgiram na fase inicial deste estudo (2010‐2013), coincidindo com uma menor experiência clínica com os ACO seletivos.
Caracterização da população submetida a encerramento percutâneo do AAE
| Idade, anos | 74 ± 8,0 |
| Género masculino, N (%) | 53 (64,6%) |
| Tipo de FA, N (%) | |
| ‐ Permanente | 53 (64,6%) |
| ‐ Persistente | 4 (4,9%) |
| ‐ Paroxística | 25 (30,5%) |
| Score CHA2DS2VASC | 4,7±1,4 |
| Score HAS‐BLED | 3,3±1,0 |
| Score HAS‐BLED ≥ 3, N (%) | 55 (67,1%) |
| Antecedentes de AVC isquémico, N (%) | 34 (41,5%) |
| Antecedentes de eventos hemorrágicos, N (%) | 49 (59,7%) |
| ‐ Gastrointestinal | 20 (24,3%) |
| ‐ Cerebral | 14 (17,1%) |
| ‐ Epistáxis recorrentes | 9 (11,0%) |
| ‐ Urológico | 6 (7,3%) |
| Hipertensão arterial, N (%) | 71 (86,6%) |
| Dislipidémia, N (%) | 35 (42,7%) |
| Diabetes mellitus tipo 2, N (%) | 26 (31,7%) |
| Doença renal crónica, N (%) | 23 (28,0%) |
| ‐ G3a: 45‐59 ml/min/1.73m2 | 8 (9,7%) |
| ‐ G3b: 30‐44 ml/min/1.73m2 | 5 (6,1%) |
| ‐ G4: 15‐29 ml/min/1.73m2 | 4 (4,9%) |
| ‐ G5: <15 ml/min/1.73m2 | 6 (7,3%) |
| ‐ Terapêutica renal de substituição (hemodiálise) | 8 (12,2%) |
| Antecedentes de doença coronária, N (%) | 18 (22,0%) |
| Hábitos tabágicos, N (%) | 11 (13,4%) |
| Doença pulmonar obstrutiva crónica, N (%) | 8 (9,7%) |
AAE: apêndice auricular esquerdo; FA: fibrilhação auricular; AVC: acidente vascular cerebral.
Dos 82 doentes selecionados para encerramento percutâneo do AAE, em três doentes (3,6%) não foi possível o encerramento do AAE. Dois deles pelas suas dimensões reduzidas e outro devido à presença de doença venosa grave. Verificou‐se uma taxa de sucesso de 96,3%. O tamanho médio do dispositivo implantado foi de 23,0±3,0mm.
Na Tabela 2 apresentam‐se as principais características técnicas do encerramento do AAE.
Características técnicas relacionadas com o procedimento
| AAE | |
| ‐ Área do AAE por ETE (cm2) | 5,6 ± 1,8 |
| ‐ Profundidade do AAE por ETE (mm) | 29,8 ± 13,6 |
| ‐ Grau de contraste espontâneo ≥ 3 no AAE | 22 (26,8%) |
| ‐ Morfologia do AAE, N (%) | |
| ‐ Windsock | 52 (63,4%) |
| ‐ Chicken wing | 14 (17,1%) |
| ‐ Cactus | 12 (14,3%) |
| ‐ Cauliflower | 4 (4,9%) |
| ‐ N.° de lobos do AAE, N (%) | |
| ‐ 1 | 56 (68,3%) |
| ‐ ≥ 2 | 26 (31,7%) |
| Dispositivos | |
| ‐ Doentes selecionados, N (%) | 82 (100%) |
| ‐ Implantação do dispositivo, N (%) | 79 (96,3%) |
| ‐ Sucesso da implantação, N (%) | 79 (96,3%) |
| ‐ Tipo de dispositivo, N (%) | |
| 1. Amulet | 44 (55,7%) |
| 2. ACP | 32 (40,5%) |
| 3. WATCHMAN | 3 (3,8%) |
| ‐ Tamanho do dispositivo usado (mm) | |
| 1. Amulet | 24,2 ± 3,6 |
| 2. ACP | 22,6 ± 5,1 |
| 3. WATCHMAN | 26,0 ± 1,7 |
AAE: apêndice auricular esquerdo; ACP: Amplatzer Cardiac Plug; ETE: ecocardiograma transesofágico.
Relativamente à técnica usada durante o procedimento, 56 implantações (68,2%) foram orientadas por ETE sob sedação profunda e 26 (31,7%) por ICE com anestesia local. Nos últimos anos (2016‐2017) o ICE tornou‐se a modalidade de imagem mais frequente com 80% dos procedimentos guiados por este método. A modalidade de imagem para guiar o procedimento não foi escolhida de acordo com a complexidade da anatomia do septo interauricular ou AAE. Nesta amostra, nenhum dos procedimentos realizados por ICE tiveram que se converter em ETE durante o procedimento percutâneo.
A visualização ecocardiográfica do AAE e a implantação foram adequadas por ambos os métodos (Tabela 3). O tempo do procedimento e de fluoroscopia, bem como, a taxa de complicações no local de acesso venoso foi reduzida com recurso ao ICE (p<0,001). Não houve diferença na taxa de encerramento, ocorrência de leaks ou existência de comunicação interauricular residual (aos seis meses) por qualquer método. Quando comparados os 10 últimos procedimentos guiados por ETE com os 10 últimos guiados por ICE verificámos que, apesar de uma tendência nos resultados, não houve diferenças estatisticamente significativas no que concerne a taxa de sucesso de encerramento (90% versus 100%, p=0,07), ocorrência de leaks (30% versus 10%, p=0,09), existência de comunicação interauricular residual aos seis meses (70% versus 50%, p=0,06), bem como, complicações periprocedimento e durante o seguimento clinico (30% versus 20%, p=0,06).
Comparação entre as duas técnicas usadas durante o procedimento e durante o seguimento
| Técnica | ETE | ICE | P |
|---|---|---|---|
| ‐ Método utilizado, N (%) | 56 (68,2%) | 26 (31,7%) | ‐ |
| ‐ Tempo de procedimento, minutos | 69,9±13,6 | 65,8±15,2 | <0,001 |
| ‐ Tempo fluoroscópico, minutos | 35,1±16,5 | 30,4±17,0 | <0,001 |
| ‐ Sucesso de implantação, N (%) | 53 (94,6%) | 26 (100%) | 0,08 |
| ‐ Complicações do periprocedimento, N (%) | 9 (16,1%) | 3 (11,5%) | 0,001 |
| ‐ Complicações durante o seguimento, N (%) | 5 (8,9%) | 0 (0%) | ‐ |
| ‐ Ocorrência de leaks, N (%) | 5 (8,9%) | 2 (7,6%) | 0,06 |
| ‐ Ocorrência de comunicação interauricular residual aos 6 meses, N (%) | 29 (35,4%) | 24 (29,3%) | 0,09 |
ETE: ecocardiograma transesofágico; ICE: ecocardiografia intracardíaca.
Nas primeiras 24 horas após o procedimento, foram identificadas duas hemorragias major com tamponamento cardíaco com necessidade de pericardiocentese (2,4%), duas hemorragias da orofaringe (2,4%) em relação com entubação orotraqueal que resolveram com medidas conservadoras. Foram também registados oito hematomas ligeiros inguinais (9,8%) no local de punção venosa e um pseudoaneurisma arterial femoral (1,2%), resolvidos com medidas minimamente invasivas.
Não foram verificadas outras complicações major periprocedimento, nomeadamente embolização do dispositivo, AVC/AIT ou morte.
Seguimento clínicoA Tabela 4 apresenta as ocorrências de relevo durante o seguimento clínico.
Complicações durante o seguimento clínico (tempo médio 23±1,0 meses)
| Complicação | N (%) | Dispositivo implantado | Tempo de identificação |
|---|---|---|---|
| Trombo aderente ao dispositivo | 1 (1,2%) | ACP | 1.° mês |
| Leak minor (largura < 3mm) | 7 (8,5%) | ACP/Amulet WATCHMAN | 1.° mês |
| Hemorragia major | 2 (2,4%) | ACP | 6 meses |
| AVC isquémico | 1 (1,2%) | WATCHMAN | 12 meses |
| Morte | 4 (4,9%) | ACP/Amulet WATCHMAN | 6 e 12 meses |
Salienta‐se que no doente com trombo aderente ao dispositivo ACP, sem shunt associado, foi substituída a dupla antiagregação em curso por anticoagulação com regressão completa do trombo após seis meses, sem qualquer complicação associada, tendo sido posteriormente continuado com antiagregação simples. A presença de fluxo peridispositivo com largura de jato de cor < 3mm no 1.° mês (N=7, 8,5%), não foi confirmada no ETE realizado após três meses do procedimento. Deste modo, não há nenhum caso com persistência de leaks (>1 mês).
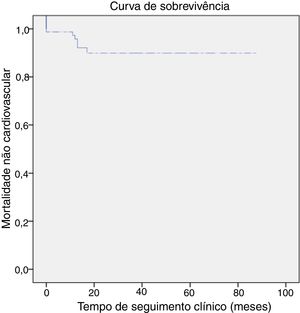
Durante o seguimento clínico de 23±1 meses (tempo mínimo um mês e máximo 79 meses) houve um AVC isquémico e duas hemorragias digestivas baixas major (necessidade de suporte transfusional). Registaram‐se quatro mortes de causa não cardiovasculares (4,9%): 3 por neoplasia do cólon e uma por choque séptico não relacionado com endocardite, 10 meses após o encerramento de AAE. De salientar que 55% dos doentes estudados apresentavam um seguimento clínico ≥ 1 ano. A Figura 2 demonstra o n.° de eventos (morte de qualquer causa) decorridos ao longo do tempo na população.
A Tabela 5 apresenta a comparação entre a terapêutica antitrombótica basal e um mês após o encerramento do AAE.
Comparação da terapêutica antitrombótica basal e um mês após o encerramento do AAE
| Fármaco | Basal | 1 mês |
|---|---|---|
| Aspirina, N (%) | 22 (26,8%) | 63 (76,8%) |
| Clopidogrel, N (%) | 9 (11,0%) | 63 (76,8%) |
| Terapêutica dupla, N (%) | 5 (6,1%) | 63 (76,8%) |
| Varfarina, N (%) | 21 (25,6%) | 3 (3,7%) |
| Novos anticoagulantes orais, N (%) | 15 (18,3%) | 5 (6,1%) |
| Terapêutica tripla, N (%) | 1 (1,2%) | 1 (1,2%) |
| Sem terapêutica, N (%) | 9 (11,0%) | 12 (14,6%) |
Na população estudada, o risco embólico estimado pelo CHA2DS2VASC foi 4,7±1,4 e o risco hemorrágico HASBLED foi 3,3±1,0. Os eventos cardioembólicos e hemorrágicos observados foram menos frequentes do que o esperado nesta população de doentes de acordo com os scores CHA2DS2VASC (0,6% versus 6,3%; p<0,001) e HASBLED (1,2% versus 4,1%, p<0,001) (Figura 3).
DiscussãoEste estudo confirma a exequibilidade e segurança do encerramento percutâneo do AAE numa população de doentes de FA não valvular com elevado risco cardioembólico e hemorrágico, em concordância com a literatura (Tabela 6). Verificámos que os três casos de insucesso de implantação ocorreram no início da nossa experiência com esta técnica percutânea, relacionado com o tamanho reduzido do AAE. No que respeita à segurança, verificaram‐se dois casos de tamponamento cardíaco (2,4%) com necessidade de pericardiocentese. As complicações hemorrágicas verificadas no local de punção venosa (11,0%) são demonstrativas da fragilidade destes doentes. De igual forma, a taxa de mortalidade total observada (4,9%) justifica‐se pela idade avançada e morbilidade aumentada desta coorte.
Principais resultados verificados nas principais séries publicadas com os diferentes dispositivos de encerramento do AAE e comparação com os nossos resultados
| Estudo clínico | Ostermayer et al.19 | Park et al.20 | Holmes et al. PROTECT‐AF15 | Reddy VY et al. CAP23 | Holmes et al. PREVAIL24 | Reis et al. |
|---|---|---|---|---|---|---|
| Tipo de dispositivo | PLAATO | ACP | WATCHMAN | WATCHMAN | WATCHMAN | ACP e WATCHMAN |
| Dispositivos programados | 111 | 143 | 449 | 460 | 269 | 82 |
| Dispositivos implantados | 108 | 137 | 408 | 437 | 256 | 79 |
| Sucesso da implantação | 97,3% | 96% | 90,9% | 95,0% | 95,1% | 96,3% |
| Derrame pericárdico com necessidade de pericardiocentese | 5 (4,5%) | 5 (3,6%) | 22 (4,9%) | 10 (2,2%) | 4 (1,5%) | 2 (2,4%) |
| Embolização do dispositivo | 0 (0%) | 2 (1,4%) | 3 (0,7%) | 0,2% | 2 (0,7%) | 0 (0%) |
| Trombo aderente ao dispositivo | 1 (0,9%) | NE | 20 (4,9%) | NE | NE | 1 (1,2%) |
| AVC/AIT | 2 (1,8%)/3 (2,7%) | 3 (2,2%)/0 (0%) | 15 (2,2%)/NE | 0(0%)/NE | 2 (0,7%) | 1 (1,2%) |
| Morte relacionada com o procedimento | 0 (0%) | NE | 2 (0,4%) | NE | NE | 0 (0%) |
AVC/AIT: acidente vascular cerebral/acidente isquémico transitório; NE: não especificado.
Não há consenso sobre o melhor protocolo antitrombótico para os doentes com contraindicação ou falência terapêutica da ACO, uma vez que esses doentes foram excluídos dos dois únicos estudos aleatorizados, como o PREVAIL e o PROTECT AF15,23,24. O encerramento do AAE em doentes com contraindicação para a ACO foi analisado pelo estudo ASAP28, demonstrando um perfil de segurança sobreponível ao verificado nos ensaios prévios e um perfil de eficácia com redução de 77% de ocorrência de AVC isquémico relativamente ao esperado pelo CHADS2. Séries mais recentes reportam resultados semelhantes29–31 (Tabela 7), colocando o encerramento percutâneo do AAE como uma terapêutica de valor clínico acrescentado nos doentes com elevado risco cardioembólico e impossibilidade de realizar ACO2.
Principais eventos tromboembólicos e hemorrágicos reportados após encerramento do AAE com o dispositivo ACP em estudos recentes e comparação com os nossos dados
| Estudo clínico | Tzikas et al.29 | Lopez Minguez et al.30 | Urena et al.31 | Jalal et al.32 | Reis et al. |
|---|---|---|---|---|---|
| Tipo de dispositivo | ACP | ACP | ACP | ACP | ACP e WATCHMAN |
| N | 1047 | 167 | 52 | 73 | 82 |
| Terapêutica antitrombótica | DUAP 1‐3 meses; AAS 3 meses | DUAP 3‐6 meses; AAS 6‐12 meses | DUAP 1‐6 meses ou AAS ou clopidogrel | Antiagregação simples | DUAP 1 mês; AAS indefinidamente |
| Seguimento clínico (meses) | 13 [6‐25] | 22±8,3 | 20±5,0 | 13±3,0 | 21±1,0 |
| Eventos tromboembólicos reais versus previstos (%/ano) | 2,3 vs 5,6 | 2,4 vs 8,3 | 3,4 vs 10,0 | 4,0 vs 9,9 | 0,6 vs 6,3 |
| Eventos hemorrágicos reais versus previstos (%/ano) | 2,0 vs 5,3 | 3,1 vs 6,6 | 3,4 vs 8,7 | 1,3 vs 4,3 | 1,2 vs 3,3 |
| Trombo associado ao dispositivo (%) | 4,4 | 8,0 | 0 | 6,8 | 1,2 |
AAS: ácido acetilsalicílico; DUAP: dupla antiagregação plaquetar.
O presente estudo compreende a maior série nacional publicada de doentes com FA não valvular submetidos a encerramento percutâneo do AAE, com tempo médio de seguimento superior a dois anos. No nosso estudo foram incluídos doentes com risco tromboembólico e hemorrágico superior ao das principais séries publicadas traduzido por um score CHA2DS2VASC e HASBLED médio mais elevado. Contudo, os eventos cardioembólicos e hemorrágicos observados na amostra foram menos frequentes do que o esperado de acordo com os mesmos scores de risco15,19,31.
A terapêutica antitrombótica é fundamental na prevenção do AVC e da embolia sistémica na FA e a sua implementação é baseada na presença ou ausência de fatores de risco. Os ACO seletivos são considerados preferenciais à varfarina na prevenção de eventos embólicos, sobretudo pela menor taxa de complicações hemorrágicas fatais e de AVC hemorrágico2. Contudo, estes fármacos apresentam algumas limitações e uma taxa de descontinuação terapêutica elevada10,12,13, tratando‐se de um grupo de doentes que necessita de uma resposta clínica adequada. Todos os ACO estão desaconselhados em doentes com antecedentes de AVC hemorrágico. A excreção renal dos ACO varia de 25% no apixabano a 80% no dabigatrano, havendo poucos dados relativos aos doentes com doença renal mais grave, dado que os principais estudos aleatorizados não avaliaram a eficácia e segurança nos doentes com taxas de filtração glomerular (TGF) <15mL/min, pelo que são desaconselhados nestas condições clínicas. A função renal deprime com a idade e, por isso, diminui também a TFG destes fármacos. Concomitantemente, os idosos têm também um risco mais elevado de hemorragia inerente à sua idade32. Face à demografia populacional com o evidente envelhecimento da população, com maior número de comorbilidades médicas e com identificação de maior número de doentes com FA não valvular com contraindicação ou falência da ACO, o encerramento percutâneo do AAE pode tornar‐se uma terapia de valor clínico acrescido para minimizar a ocorrência de AVC e hemorragias graves.
Este estudo reporta a primeira série de encerramento do AAE com a utilização consecutiva do ICE na aurícula esquerda, como forma de guiar o procedimento com segurança e eficácia. A monitorização ecocardiográfica é prática habitual durante o encerramento percutâneo do AAE, sendo o ETE o método mais utilizado para o efeito, por apresentar excelente resolução espacial. Contudo, o ETE tem algumas limitações, nomeadamente a necessidade de sedação profunda, a ocorrência de potenciais complicações associadas à manipulação da via aérea, particularmente importantes nos doentes com morbilidade aumentada. O ICE constitui uma técnica de imagem particularmente interessante para os doentes com doença pulmonar obstrutiva crónica grave, varizes esofágicas ou patologia gastroesofágica que acarrete maior risco hemorrágico (Tabela 8).
Vantagens e desvantagens de utilização de Ecocardiografia intracardíaca
| Vantagens do ICE |
| Resolução espacial alta → procedimento seguro quando o ETE está contraindicado. |
| Anestesia local → sem necessidade de anestesia/sedação profunda. |
| Melhoria do fluxo de trabalho na sala de hemodinâmica → maior turnover de doentes. |
| Menos complicações relacionadas com a realização do ETE → maior conforto do paciente. |
| Procedimento livre de contraste → Menos casos de nefropatia de contraste. |
| Recuperação mais rápida do doente → menor custo do internamento. |
| Desvantagens do ICE |
| Punção venosa adicional → potencial para complicações. |
| Curva de aprendizagem → mais fácil se experiência com ETE. |
| Catéter de uso único → potencial para reutilização. |
| ETE permite visões multiplanares e 3D (plano 110‐135°). |
ETE: ecocardiograma transesofágico; ICE: ecocardiografia intracardíaca.
A proficiência em ambas as técnicas de imagem para guiar o procedimento percutâneo poderá ser uma mais valia clínica ao permitir o encerramento percutâneo do AAE em doentes em que o ETE está desaconselhado (Tabela 9). A escolha entre o ICE e o ETE deve ter em conta a anatomia e morbilidade do doente e o apoio anestésico de cada instituição. Ainda que neste estudo não houve necessidade de converter a modalidade de imagem de ICE para ETE, em casos de anatomia cardíaca mais complexa o ETE poderá ser o método preferencial por possibilitar a utilização de planos ecocardiográficos bem estabelecidos, a imagem multiplanar e tridimensional.
Potenciais contraindicações para realização de Ecocardiograma transesofágico
| Patologia gastroesofágica |
| (tumores, divertículos, escleroderma, hérnia do hiato sintomática) |
| Hemorragia digestiva alta ativa/recente |
| Esofagectomia |
| Artrite cervical severa |
| Esofagite/úlcera péptica |
| Disfagia crónica |
| Aneurisma tóraco‐abdominal |
O ICE foi sobretudo utilizado para guiar os principais passos do encerramento percutâneo do AAE com segurança e eficácia. Para a seleção do tamanho do dispositivo de encerramento, eram utilizadas as medições ecocardiográficas (ETE do dia prévio, ICE) e angiográficas. O ICE não garante a visualização do maior diâmetro do AAE (landing zone) em todos os casos, pelo que se torna fundamental complementar as medições do AAE com dados de outras modalidades de imagem (ETE, tomografia cardíaca e angiografia).
Nesta amostra foram comparadas as duas técnicas ecocardiográficas, não se tendo verificado diferenças na taxa de sucesso de implantação de dispositivo, nem nos leaks peridispositivo ao 1.° mês por ETE. O tempo do procedimento, fluoroscópico e complicações, nomeadamente as referentes ao local de punção femoral, não estiveram aumentadas no grupo que realizou ICE. Verificámos que o uso do ICE levou a simplificação do procedimento, menor número de elementos na sala de hemodinâmica, menor tempo de sala e menor tempo de recobro.
LimitaçõesEste estudo tem algumas limitações pois é baseado num único centro. Trata‐se de uma população muito selecionada com risco cardioembólico e hemorrágico muito elevado. O número de doentes submetidos a encerramento percutâneo do AAE guiados por ICE é pequeno e surgiu numa fase de maior maturidade da técnica. Os resultados deste estudo não permitem uma comparação adequada entre as duas modalidades ecocardiográficas (ETE versus ICE) por não ter sido aleatorizada, com potencial enviesamento de seleção dos casos e diferentes fases de maturação técnica. No entanto, mesmo quando comparados os últimos 10 casos realizados por ETE e por ICE, a técnica intracardíaca não traduziu resultados inferiores quando comparada com o ETE.
Outra limitação do estudo foi a não realização de angiotomografia cardíaca nestes doentes, tendo a caracterização do AAE sido realizada em todos os casos por ETE.
ConclusõesNesta amostra, o encerramento percutâneo do AAE foi considerado seguro e eficaz comparativamente aos eventos estimados pelo CHA2DS2VASc e HASBLED.
Os procedimentos guiados por ICE na aurícula esquerda não tiveram resultados clínicos ou imagiológicos inferiores aos procedimentos conduzidos por ETE.
Conflito de interessesOs autores declaram não haver conflito de interesses.