A polineuropatia amiloidótica familiar (PAF) é uma doença rara devida à deposição sistémica de variantes amiloidogénicas da proteína transtirretina (TTR). A TTR‐V30M consiste na substituição da valina pela metionina na posição 30 e atinge especialmente o sistema nervoso periférico e autonómico. As manifestações cardiovasculares são muito comuns e devem‐se à desnervação autonómica e à deposição de amiloide no coração. A desnervação simpática cardíaca, detetada por cintigrafia com metaiodobenzilguanidina (MIBG) marcada com I123, é um importante estratificador prognóstico na PAF TTR‐V30M. O transplante hepático, amplamente utilizado para interromper a progressão do envolvimento neurológico, parece ter impacto heterogéneo na evolução da miocardiopatia amiloidótica. O seu impacto na progressão da desnervação cardíaca permanece desconhecido.
MétodosEstudo observacional de portadores da mutação TTR‐V30M submetidos a avaliação cardiológica anual e a cintigrafias com MIBG seriadas, com quantificação do índice de captação coração/mediastino (C/M) tardio.
ResultadosForam estudados 232 doentes (idade mediana de 40 anos, 54,7% do sexo feminino, 37,9% assintomáticos aquando da inclusão), seguidos durante uma mediana de 4,5 anos e submetidos a um total de 558 cintigrafias MIBG. Durante o seguimento, 47 doentes (20,3%) morreram. A cintigrafia com MIBG inicial foi um forte preditor prognóstico, detetando‐se aumento do risco de morte em 27,8% por cada redução decimal do índice C/M tardio. O índice C/M tardio diminuiu com a idade (0,082 por ano; p<0,001), mas a progressão da desnervação cardíaca foi tão lenta que a repetição anual do exame não aumentou a sua precisão prognóstica. Durante o seguimento, 70 doentes sintomáticos foram submetidos a transplante hepático. O índice C/M tardio diminuiu 0,19/ano até ao transplante, deixando de ser detetadas variações estatisticamente significativas a partir do procedimento.
ConclusãoA desnervação cardíaca é frequente durante a progressão da PAF TTR‐V30M e a quantificação do índice C/M tardio por cintigrafia MIBG é valiosa para a estratificação prognóstica destes doentes. O transplante hepático permite a estabilização da desnervação cardíaca, não havendo recuperação ou deterioração adicional da captação cardíaca de MIBG após o procedimento.
Familial amyloid polyneuropathy (FAP) is a rare disease caused by systemic deposition of amyloidogenic variants of the transthyretin (TTR) protein. The TTR‐V30M mutation is caused by the substitution of valine by methionine at position 30 and mainly affects the peripheral and autonomic nervous systems. Cardiovascular manifestations are common and are due to autonomic denervation and to amyloid deposition in the heart. Cardiac sympathetic denervation detected by iodine‐123 labeled metaiodobenzylguanidine (MIBG) is an important prognostic marker in TTR‐V30M FAP. Liver transplantation, widely used to halt neurological involvement, appears to have a varying effect on the progression of amyloid cardiomyopathy. Its effect on the progression of cardiac denervation remains unknown.
MethodsIn this observational study, patients with the TTR‐V30M mutation underwent annual cardiac assessment and serial MIBG imaging with quantification of the late heart‐to‐mediastinum (H/M) ratio.
ResultsWe studied 232 patients (median age 40 years, 54.7% female, 37.9% asymptomatic at the time of inclusion) who were followed for a median of 4.5 years and underwent a total of 558 MIBG scans. During follow‐up, 47 patients (20.3%) died. MIBG scintigraphy at inclusion was a strong predictor of prognosis, with the risk of death increasing by 27.8% for each one‐tenth reduction in the late H/M ratio. The late H/M ratio decreased with age (0.082/year, p<0.001), but progression of cardiac denervation was so slow that annual repetition of MIBG imaging did not increase its prognostic accuracy. During follow‐up, 70 symptomatic patients underwent liver transplantation. The late H/M ratio decreased by 0.19/year until transplantation but no statistically significant differences were detected after the procedure.
ConclusionsCardiac denervation is common during the progression of TTR‐V30M FAP and quantification of the late H/M ratio on MIBG scintigraphy is valuable for prognostic stratification of these patients. Liver transplantation stabilizes cardiac denervation, without recovery or further deterioration in cardiac MIBG uptake after the procedure.
A polineuropatia amiloidótica familiar (PAF) causada pela mutação da transterritina (TTR) com substituição da valina pela metionina na posição 30 (V30M) é uma doença hereditária multissistémica caracterizada por comprometimento progressivo das fibras nervosas sensitivo‐motoras e autonómicas1,2. As manifestações neurológicas dominam o quadro clínico, mas o envolvimento cardiovascular originado por neuropatia autonómica e pela deposição cardíaca de amiloide também é muito frequente3.
A cintigrafia miocárdica com metaiodobenzilguanidina (MIBG)‐I123 é um método não invasivo para quantificação da inervação simpática cardíaca. Estudos prévios demonstraram que a inervação simpática miocárdica detetada nas imagens com MIBG‐I123 está diminuída numa fase inicial da doença4,5 e que a redução do índice de captação coração/mediastino (C/M) tardio de MIBG‐I123 é um valioso preditor prognóstico, associando‐se fortemente ao risco de mortalidade a longo prazo6. No entanto, a progressão da desnervação cardíaca durante a evolução da PAF TTR‐V30M nunca foi caracterizada em cintigrafias seriadas com MIBG‐I123, e o eventual valor acrescido de avaliações repetidas do índice C/M tardio para fins de estratificação de prognóstico permanece desconhecido.
O transplante hepático tem sido amplamente usado para atenuar a progressão da PAF e até recentemente era a única opção terapêutica para estes doentes7. O transplante hepático interrompe a progressão do compromisso neurológico e melhora a sobrevivência, especialmente se for realizado nas fases iniciais da doença sintomática6. Em contrapartida, a amiloidose cardíaca pode continuar a progredir após o transplante hepático, levando a espessamento progressivo do miocárdio, arritmias e defeitos da condução cardíaca8–13. No entanto, pouco se sabe sobre a evolução da desnervação cardíaca após o transplante hepático.
Deste modo, o nosso objetivo foi avaliar o impacto do transplante hepático na progressão da desnervação cardíaca em doentes com PAF TTR‐V30M.
MétodosRealizou‐se um estudo observacional prospetivo de indivíduos consecutivos portadores da mutação TTR‐V30M. Todos os doentes foram submetidos a avaliação cardiológica anual e procedeu‐se periodicamente a determinação do índice de captação C/M de MIBG‐I123. A progressão da desnervação cardíaca foi avaliada pela comparação dos índices de captação C/M em exames sucessivos.
Cintigrafia com MIBG‐I123. A cintigrafia foi realizada após pré medicação com uma solução de iodeto de potássio (solução de Lugol) para bloquear a absorção de I123 livre pela glândula tiroide. Não se suspendeu qualquer terapêutica crónica previamente à realização do exame. Adquiriram‐se imagens planares torácicas anteriores, 15 minutos (imagem precoce) e três horas (imagem tardia) após a injeção intravenosa de uma dose fixa de 185MBq de MIBG‐I123. As imagens foram realizadas utilizando um sistema com uma câmara de duas cabeças (Millenium, General Electric Healthcare) equipado com um colimador de orifícios paralelos, baixa energia e alta resolução. Utilizou‐se uma janela de energia de 20% centrada sobre o fotopico de 159keV do I123.
A captação de MIBG‐I123 foi quantificada através do cálculo do índice C/M, o qual foi determinado dividindo o número de contagens médias/pixel de uma região de interesse desenhada à volta do coração pelo número de contagens médias/pixel do mediastino, sem correção para a atividade de fundo. O washout rate (WR) miocárdico foi calculado como a percentagem de redução das contagens miocárdicas entre as imagens precoces e as tardias: ([índice C/M precoce – C/M tardio]/índice C/M precoce)x100.
Análise estatísticaAs variáveis contínuas com distribuição normal foram expressas pela média±desvio padrão e foram comparadas usando os testes t‐Student/ANOVA. As variáveis contínuas com distribuição não‐normal foram descritas pela mediana e distribuição interquartil (DIQ), e foram comparadas usando os testes de Mann‐Whitney/Kruskal‐Wallis. Os parâmetros do MIBG foram correlacionados com a idade, duração dos sintomas e tempo decorrido até e após o transplante hepático, utilizando‐se o coeficiente de Pearson e a correlação de Spearman.
O impacto prognóstico dos parâmetros do MIBG na predição de morte por qualquer causa durante o seguimento foi determinado usando‐se análises de regressão de Cox univariadas e multivariadas (com ajustamento para a idade). Para evitar enviesamento, as análises multivariadas foram realizadas aplicando‐se métodos sequenciais condicionais, em que foram removidos do modelo em cada etapa as variáveis não significativas (valor p para inclusão de variável de 0,05 e para a remoção de 0,10). A precisão dos modelos de predição de mortalidade foi avaliada pela área sob a curva receiver operator characteristic (ROC), considerando diferentes durações de seguimento. As taxas cumulativas de eventos em função da distribuição por quartis do índice C/M tardio foram avaliadas utilizando o método de Kaplan‐Meier e o teste log‐rank. A análise estatística foi realizada com o software SPSS versão 21.0 (SPSS Inc., Chicago, Illinois), considerando‐se estatisticamente significativo um valor de p<0,05.
ResultadosCaracterização da populaçãoEntre setembro de 1998 e julho de 2015, 305 portadores da mutação TTR‐V30M foram submetidos a avaliação cardiovascular. Foram excluídos da presente análise 73 doentes: 45 porque não realizaram cintigrafia com MIBG e 28 porque a primeira cintigrafia foi efetuada já após transplantação hepática. A população final foi composta por 232 doentes, com idade mediana de 40 (DIQ: 32‐55) anos, 54,7% dos quais do sexo feminino (n=127).
Aquando da avaliação cardíaca inicial, 144 doentes (62,1%) tinham compromisso neurológico estabelecido, correspondendo os restantes 88 (37,9%) indivíduos a portadores assintomáticos. Dos doentes sintomáticos, 99 tinham desenvolvido manifestações clínicas antes dos 50 anos de idade. Nos restantes 45 doentes, a apresentação clínica ocorreu após os 50 anos (doença de início tardio). A idade média de início dos sintomas foi de 38 (DIQ: 31‐54) anos e a duração média dos sintomas aquando da avaliação cardíaca inicial foi de dois (DIQ: 0‐3) anos. Dezanove portadores de mutação patogénica permaneciam livres de sintomas apesar de terem mais de 50 anos.
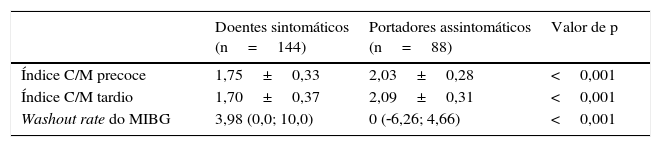
Cintigrafia com MIBG‐I123Aquando da primeira avaliação, os valores médios do índice C/M precoce e tardio foram, respetivamente, 1,85±0,23 e 1,83±0,03, e o valor mediano do WR foi de 2,5 (DIQ: ‐2,3‐8,5). Os índices C/M precoce e tardio foram significativamente menores nos doentes sintomáticos, enquanto o WR foi significativamente mais elevado nesses doentes (Tabela 1).
Comparação dos parâmetros de MIBG em função do envolvimento neurológico
| Doentes sintomáticos (n=144) | Portadores assintomáticos (n=88) | Valor de p | |
|---|---|---|---|
| Índice C/M precoce | 1,75±0,33 | 2,03±0,28 | <0,001 |
| Índice C/M tardio | 1,70±0,37 | 2,09±0,31 | <0,001 |
| Washout rate do MIBG | 3,98 (0,0; 10,0) | 0 (‐6,26; 4,66) | <0,001 |
C/M: captação de MIBG coração/mediastino.
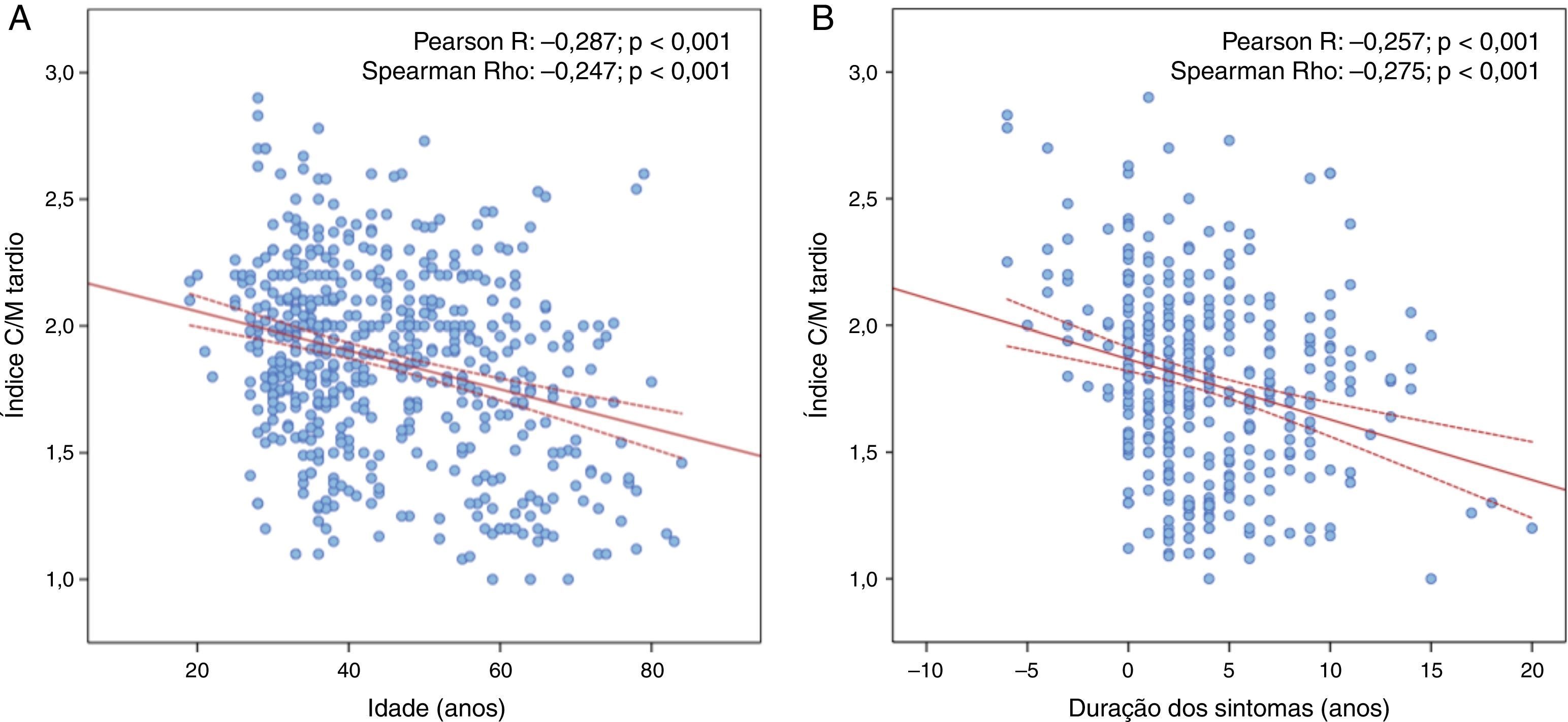
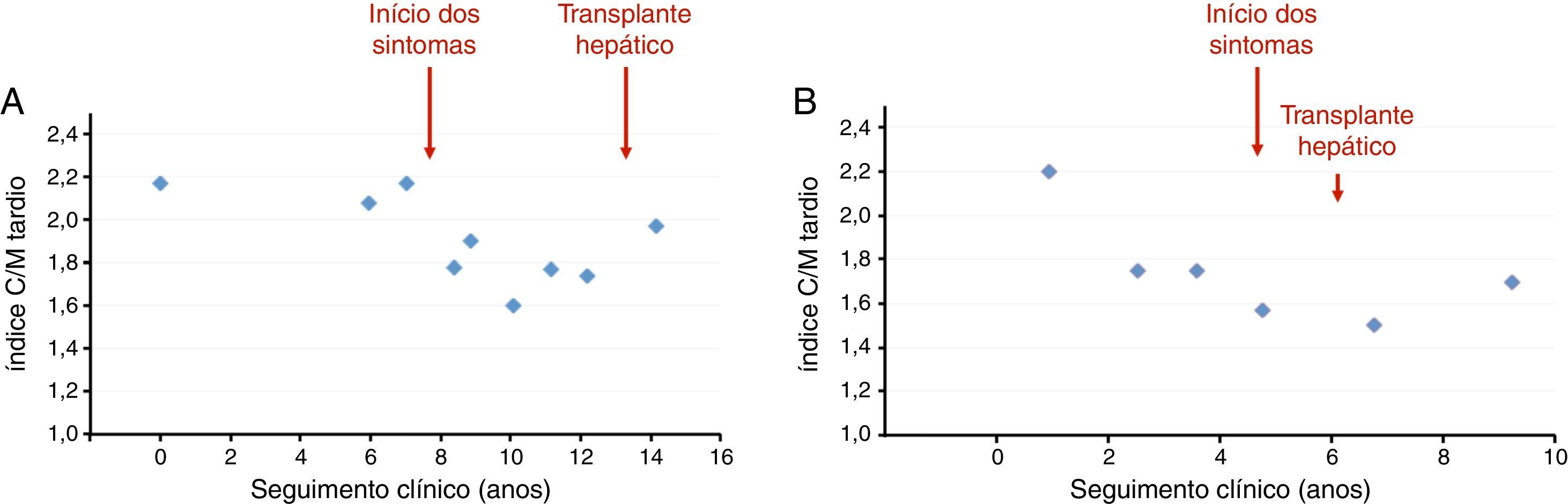
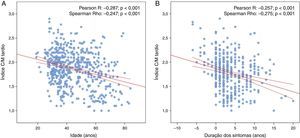
Durante um seguimento mediano de 4,5 anos (DIQ: 2,1‐7,7; máximo: 15,6), 121 doentes foram submetidos a cintigrafias seriadas, incluindo pelo menos cinco exames em 36 doentes (máximo: 9) – Tabela Suplementar 1. Considerando a avaliação inicial e as avaliações subsequentes, foram realizadas um total de 558 cintigrafias MIBG na população estudada. Nestes exames, o índice C/M tardio diminuiu com a idade (0,082 por ano; p<0,001) e com a duração dos sintomas (0,066 por ano; p<0,001) – Figura 1 e Appendix B, de forma similar em ambos os sexos (Appendix B). Na Figura 2 é apresentada a progressão do índice C/M tardio em cintigrafias MIBG seriadas de dois doentes exemplificativos, ilustrando a lenta redução na fase pré‐sintomática da doença, o declínio mais pronunciado do índice C/M tardio após o início dos sintomas e a aparente estabilização após o transplante hepático.
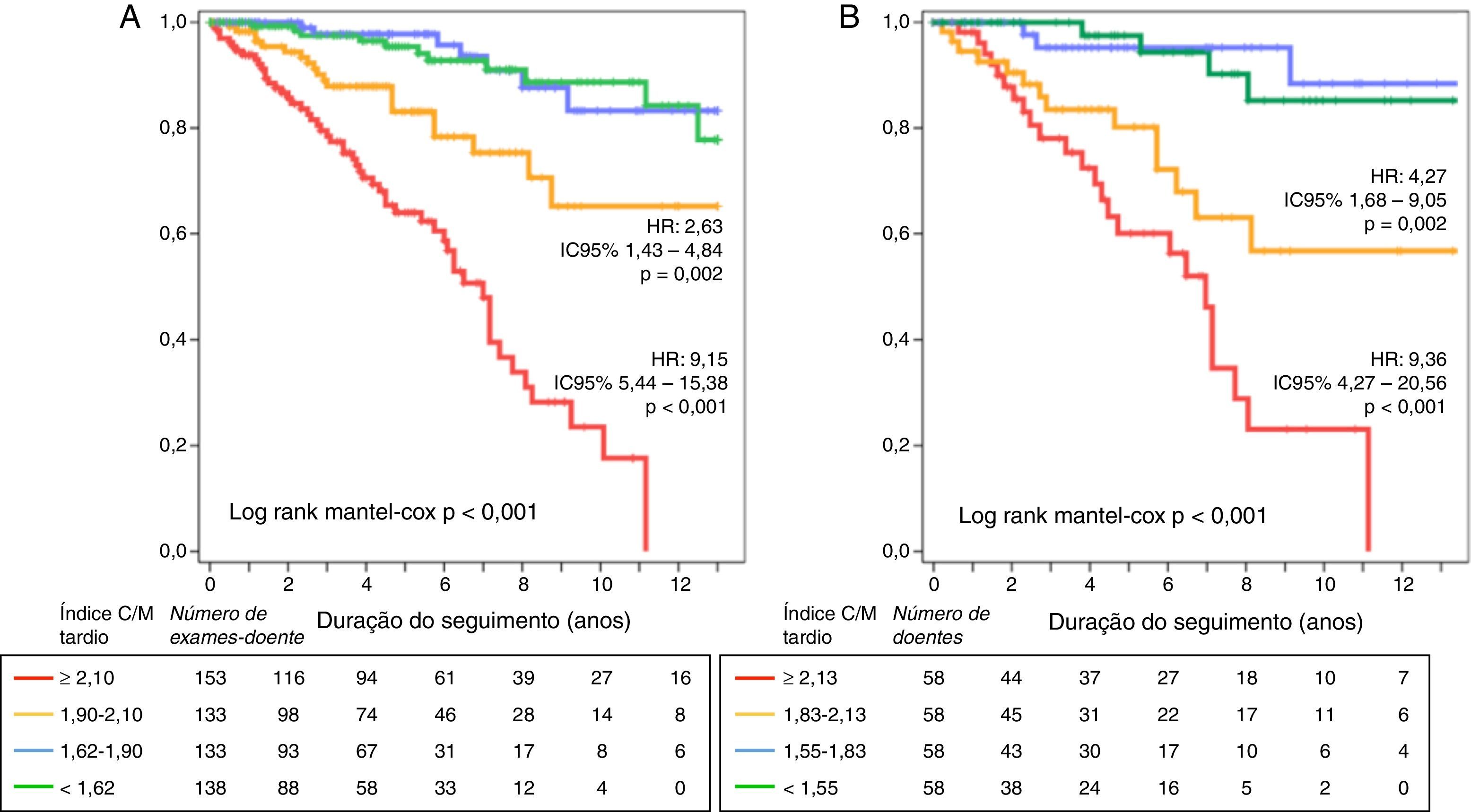
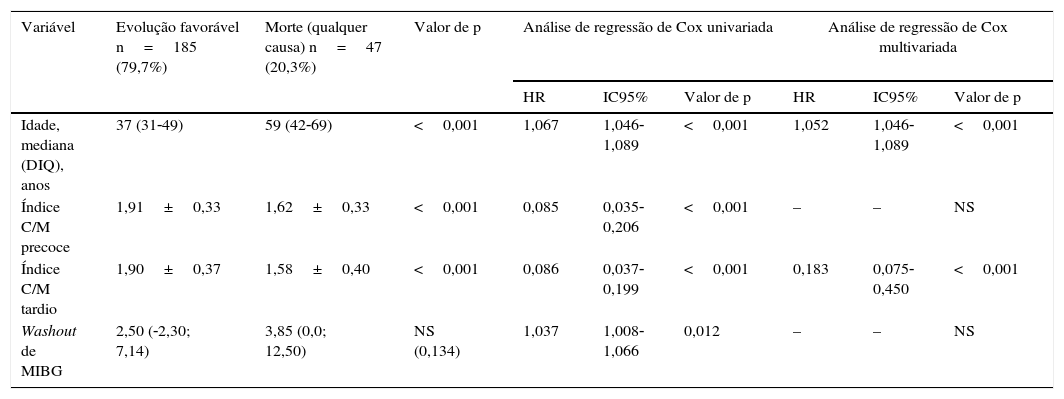
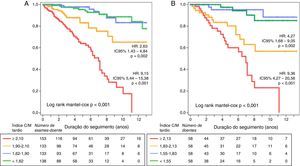
Estratificação prognósticaDurante o seguimento, 47 doentes (20,3%) morreram. A causa mais frequente de morte foi a PAF terminal, correspondendo a 40% de todas as causas de morte (Appendix B). O índice C/M tardio da cintigrafia inicial foi um forte preditor da mortalidade, tendo o risco relativo de morte por qualquer causa aumentado em 27,8% (intervalo de confiança de 95% [IC95%] 17,5‐39,1) por cada décimo de redução do índice C/M tardio (hazard ratio [HR]: 0,78; IC95% 0,72‐0,85; p<0,001). Dos parâmetros do MIBG, o único preditor independente do prognóstico foi o índice C/M tardio – Tabela 2. A mortalidade foi nove vezes mais elevada nos doentes com índices C/M mais reduzidos aquando da avaliação inicial (ou seja 1.° quartil, <1,55), quando comparada com os indivíduos com índice C/M acima do valor mediano da população (ou seja≥1,83; HR: 9,36; IC95% 4,27‐20,56; p<0,001). Além disso, a mortalidade foi quatro vezes mais elevada em doentes com redução moderada do índice C/M tardio, ou seja entre 1,55‐1,83 (HR: 4,27 IC95% 1,68‐9,05; p=0,002) – Figura 3A.
Mortalidade durante o seguimento, em função da idade e dos parâmetros de MIBG na avaliação inicial
| Variável | Evolução favorável n=185 (79,7%) | Morte (qualquer causa) n=47 (20,3%) | Valor de p | Análise de regressão de Cox univariada | Análise de regressão de Cox multivariada | ||||
|---|---|---|---|---|---|---|---|---|---|
| HR | IC95% | Valor de p | HR | IC95% | Valor de p | ||||
| Idade, mediana (DIQ), anos | 37 (31‐49) | 59 (42‐69) | <0,001 | 1,067 | 1,046‐1,089 | <0,001 | 1,052 | 1,046‐1,089 | <0,001 |
| Índice C/M precoce | 1,91±0,33 | 1,62±0,33 | <0,001 | 0,085 | 0,035‐0,206 | <0,001 | – | – | NS |
| Índice C/M tardio | 1,90±0,37 | 1,58±0,40 | <0,001 | 0,086 | 0,037‐0,199 | <0,001 | 0,183 | 0,075‐0,450 | <0,001 |
| Washout de MIBG | 2,50 (‐2,30; 7,14) | 3,85 (0,0; 12,50) | NS (0,134) | 1,037 | 1,008‐1,066 | 0,012 | – | – | NS |
C/M: captação de MIBG coração/mediastino; DIQ: distribuição interquartis; HR: hazard ratio; IC95%: intervalo de confiança de 95%; NS: não significativo.
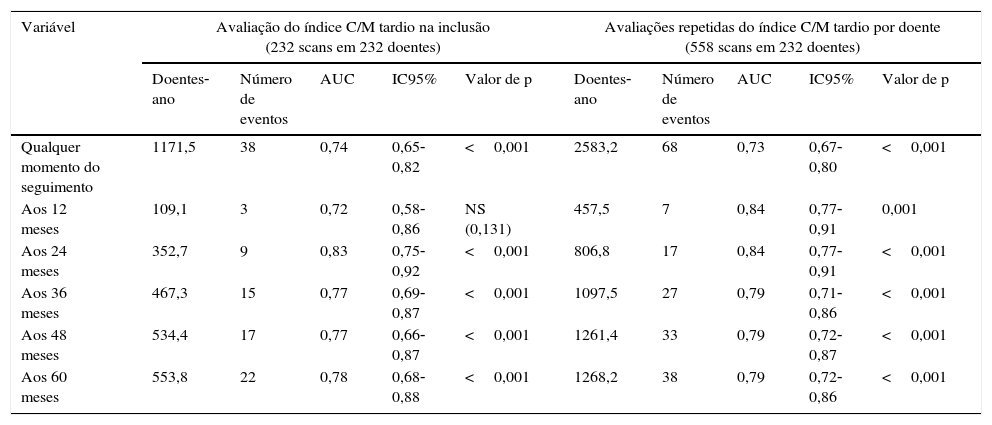
Para determinar a eventual utilidade acrescida da avaliação seriada do índice C/M tardio para finalidade de estratificação prognóstica, avaliou‐se a precisão da totalidade das cintigrafias com MIBG realizadas na previsão da sobrevida pós‐exame. Portanto, considerando os 558 exames realizados e um total de 2246 doentes‐ano de seguimento, verificou‐se uma redução significativa da sobrevivência pós‐exame com a diminuição do índice C/M tardio. Assim, a mortalidade aumentou 29% por cada declínio decimal do índice C/M tardio (HR: 0,774, IC95% 0,73‐0,82; p<0,001), sendo nove vezes mais elevada nos doentes pertencentes ao 1.° quartil do índice C/M tardio (HR: 9,15; IC95% 5,44 ‐15,38; p<0,001) – Figura 3B. A precisão da previsão prognóstica baseada nas avaliações seriadas foi determinada pela análise das curvas ROC para vários intervalos de tempo e comparada com a estratificação prognóstica baseada apenas na cintigrafia com MIBG inicial – Tabela 3. A precisão da estratificação prognóstica baseada em exames seriados foi ligeiramente superior, mas as diferenças foram irrisórias para os intervalos de tempo abaixo da mediana do seguimento disponível (ou seja, 4,5 anos). O poder estatístico da estratificação prognóstica baseada num único exame ou em exames seriados foi semelhante e muito elevado: 99%.
Precisão dos modelos de predição da mortalidade avaliada pela análise de curvas receiver operator characteristic analysis (ROC)
| Variável | Avaliação do índice C/M tardio na inclusão (232 scans em 232 doentes) | Avaliações repetidas do índice C/M tardio por doente (558 scans em 232 doentes) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Doentes‐ano | Número de eventos | AUC | IC95% | Valor de p | Doentes‐ano | Número de eventos | AUC | IC95% | Valor de p | |
| Qualquer momento do seguimento | 1171,5 | 38 | 0,74 | 0,65‐0,82 | <0,001 | 2583,2 | 68 | 0,73 | 0,67‐0,80 | <0,001 |
| Aos 12 meses | 109,1 | 3 | 0,72 | 0,58‐0,86 | NS (0,131) | 457,5 | 7 | 0,84 | 0,77‐0,91 | 0,001 |
| Aos 24 meses | 352,7 | 9 | 0,83 | 0,75‐0,92 | <0,001 | 806,8 | 17 | 0,84 | 0,77‐0,91 | <0,001 |
| Aos 36 meses | 467,3 | 15 | 0,77 | 0,69‐0,87 | <0,001 | 1097,5 | 27 | 0,79 | 0,71‐0,86 | <0,001 |
| Aos 48 meses | 534,4 | 17 | 0,77 | 0,66‐0,87 | <0,001 | 1261,4 | 33 | 0,79 | 0,72‐0,87 | <0,001 |
| Aos 60 meses | 553,8 | 22 | 0,78 | 0,68‐0,88 | <0,001 | 1268,2 | 38 | 0,79 | 0,72‐0,86 | <0,001 |
AUC: área sob a curva receiver operator characteristic. Todas as outras abreviaturas conforme a Tabela 2.
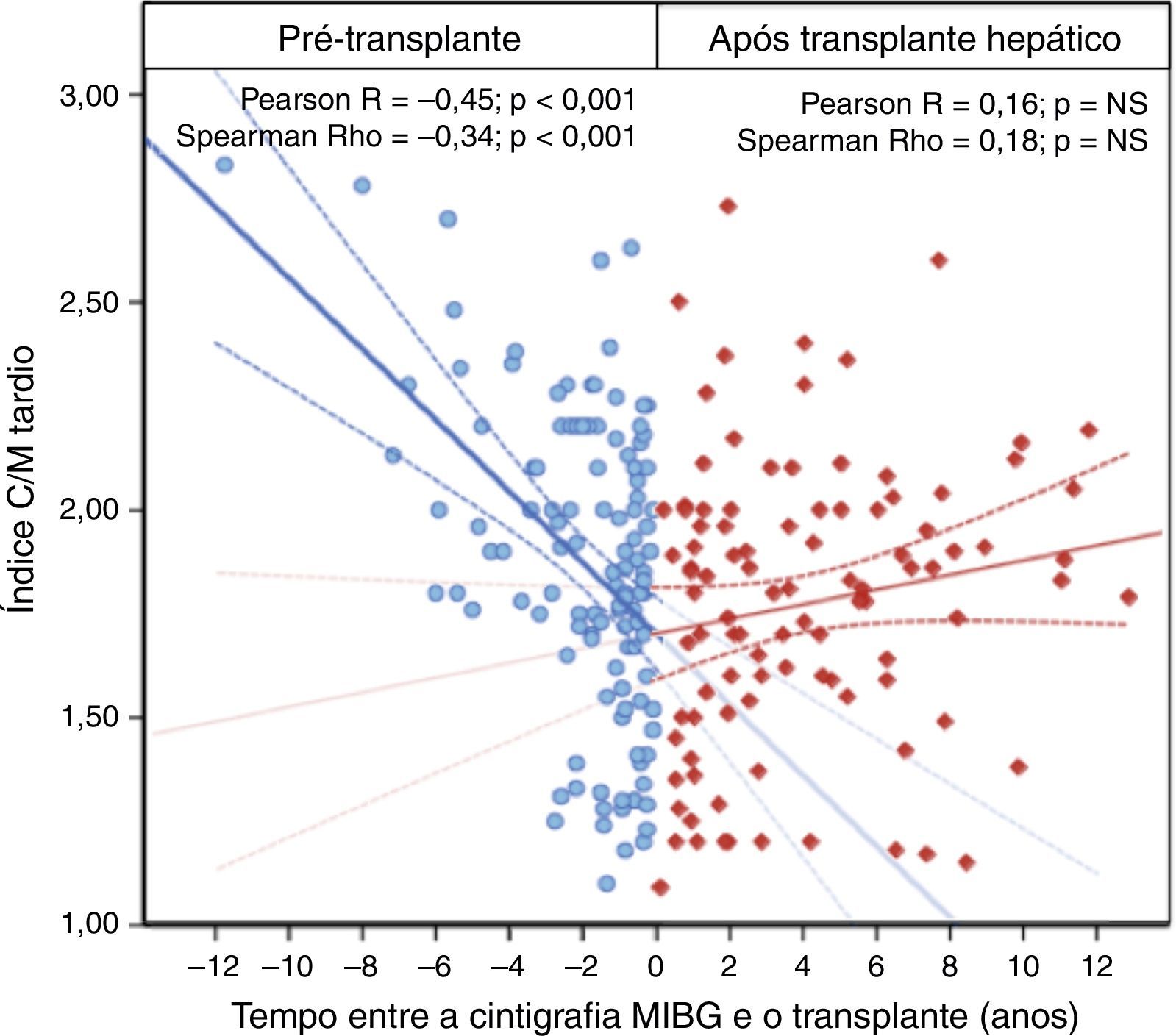
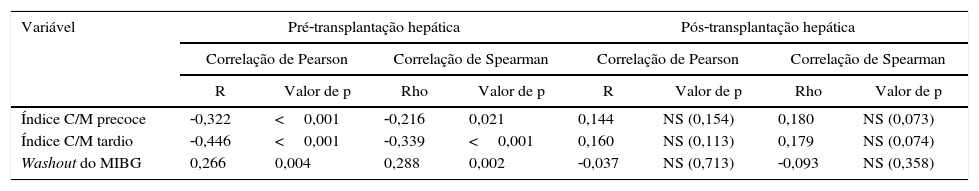
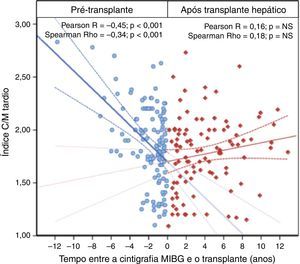
Setenta doentes (30,2%) foram submetidos a transplante hepático. Em 39 destes doentes, a cirurgia foi realizada menos de um ano após a avaliação inicial. A mortalidade perioperatória foi de 7,1% (5/70). Para determinar o impacto da transplantação hepática na progressão da inervação simpática, comparou‐se a taxa de redução do índice de captação C/M tardio nas imagens realizadas antes do transplante hepático (116 exames) com a diminuição do índice de captação C/M tardio nas imagens adquiridas posteriormente (100 exames). Dos exames efetuados antes da cirurgia, 53 foram realizados durante o ano que antecedeu o transplante. Nos doentes sintomáticos que necessitaram de transplante hepático, o índice C/M tardio diminuiu a uma taxa de 0,19/ano (p<0,001) antes do procedimento. Além disso, o índice C/M precoce também diminuiu progressivamente e o WR de MIBG aumentou. Pelo contrário, todos os parâmetros MIBG estabilizaram após o transplante hepático, não apresentando diferenças estatisticamente significativas ao longo do tempo – Tabela 4 e Figura 4.
Correlação entre as variáveis do MIBG e o tempo decorrido, antes e após a transplantação hepática
| Variável | Pré‐transplantação hepática | Pós‐transplantação hepática | ||||||
|---|---|---|---|---|---|---|---|---|
| Correlação de Pearson | Correlação de Spearman | Correlação de Pearson | Correlação de Spearman | |||||
| R | Valor de p | Rho | Valor de p | R | Valor de p | Rho | Valor de p | |
| Índice C/M precoce | ‐0,322 | <0,001 | ‐0,216 | 0,021 | 0,144 | NS (0,154) | 0,180 | NS (0,073) |
| Índice C/M tardio | ‐0,446 | <0,001 | ‐0,339 | <0,001 | 0,160 | NS (0,113) | 0,179 | NS (0,074) |
| Washout do MIBG | 0,266 | 0,004 | 0,288 | 0,002 | ‐0,037 | NS (0,713) | ‐0,093 | NS (0,358) |
Abreviaturas conforme a Tabela 2.
Neste grande estudo prospetivo de portadores da mutação TTR‐V30M, seguidos durante uma mediana de 4,5 anos, caracterizámos a progressão da desnervação simpática cardíaca, avaliada pelo índice de captação C/M de MIBG, a importância do índice na sobrevivência a longo prazo e o impacto do transplante hepático na progressão da desnervação cardíaca. Os resultados mais relevantes são os seguintes: (1) a desnervação cardíaca progride lentamente na fase pré‐sintomática da doença, mas tende a diminuir de forma mais acentuada após o início dos sintomas; (2) o índice C/M tardio é um forte preditor de prognóstico, aumentando o risco de morte em 27,8% para cada redução decimal do índice C/M tardio; e (3) o transplante hepático, amplamente utilizado para atenuar a progressão neurológica da PAF, estabiliza a desnervação cardíaca no seguimento a longo prazo.
As manifestações cardiovasculares da PAF TTR‐V30M são causadas por disfunção autonómica (distúrbios do controlo da pressão arterial e da frequência cardíaca) e por deposição cardíaca de amiloide (miocardiopatia infiltrativa, arritmias e defeitos de condução). No entanto, existem diferenças fenotípicas entre os doentes com a mutação TTR‐V30M dependente da origem geográfica. Estudos de coortes de doentes suecos com TTR‐V30M descrevem uma elevada prevalência de miocardiopatia restritiva3,14, a qual é bastante rara em doentes portugueses, onde a neuropatia autonómica cardíaca e os defeitos de condução tendem a dominar o quadro clínico6.
Estudos prévios mostraram que a cintigrafia com MIBG permite visualizar indiretamente o compromisso da inervação simpática cardíaca devido a depósito amiloide. Nakata et al.15 foram os primeiros a relatar um caso de um doente com PAF TTR‐V30M que apresentava ausência da atividade miocárdica de MIBG, indicando comprometimento dos nervos simpáticos. Pequenos estudos subsequentes relataram não só uma forte correlação entre a desnervação miocárdica e a gravidade da polineuropatia16, mas também que a redução da captação de MIBG pode ocorrer antes do desenvolvimento de doença cardíaca, clinicamente aparente5. Num estudo anterior, envolvendo 143 indivíduos, documentámos que as anomalias cardiovasculares avaliadas por ECG, Holter, monitorização ambulatória da pressão arterial, ecocardiograma e cintigrafia com MIBG são muito comuns na PAF TTR‐V30M, particularmente em doentes com atingimento neurológico6. Em contraste com outras formas de amiloidose sistémica, as anomalias cardiovasculares no nosso estudo foram, geralmente, subclínicas e as manifestações cardíacas óbvias foram bastante raras. No entanto, verificámos que as manifestações cardiovasculares subclínicas antecedem muitas vezes o envolvimento neurológico, oferecendo uma oportunidade para o reconhecimento atempado do início da doença em portadores assintomáticos. Além disso, demonstrámos o valor prognóstico das cintigrafias com MIBG, as quais foram, na realidade, o preditor prognóstico mais forte entre os vários parâmetros cardíacos e neurológicos avaliados. Os doentes com desnervação cardíaca detetada pelo índice C/M inferior a 1,60 apresentaram um risco de morte sete vezes maior, durante o seguimento.
A presente análise confirma esses achados prévios numa população mais alargada e estende os resultados através da realização de avaliações seriadas do índice C/M. Como esperado, o índice C/M tardio diminuiu significativamente ao longo do tempo, mas a progressão da desnervação cardíaca foi tão lenta que a repetição anual das cintigrafias com MIBG não aumentou a precisão prognóstica para prever a morte por qualquer causa. Portanto, o nosso estudo sugere que a avaliação repetida do índice C/M, para fins de estratificação do prognóstico, não se justifica, pelo menos se for realizada a intervalos de tempo menores do que cinco anos (a duração mediana de seguimento do presente estudo).
O transplante hepático tem sido largamente utilizado nos últimos vinte anos para remover a principal fonte de produção da transtirretina mutante, travar a progressão das manifestações clínicas da doença, incluindo a neuropatia periférica, os sintomas gastrointestinais e outras complicações viscerais7,17–20. Além disso, o transplante tem um impacto favorável na sobrevivência a longo prazo, especialmente se for realizado nas fases iniciais da doença sintomática6,21. No entanto, o impacto do transplante hepático na progressão da miocardiopatia na TTR‐V30M permanece controverso. Alguns estudos sugeriram que os doentes transplantados não desenvolvem miocardiopatia evidente22,23, enquanto outros, em doentes suecos10,13, franceses12 e japoneses9, relataram progressão de arritmias e espessamento do miocárdio, devido à deposição de amiloide. Esta progressão adversa parece ser mais frequente em doentes suecos com início tardio da TTR‐V30M3,10,13. Tem sido sugerido que o principal componente dos depósitos cardíacos de amiloide que se estabelecem após a transplantação hepática é a transtirretina normal (wild type TT”)24. No entanto, nenhum dos estudos que avaliaram a progressão ecocardiográfica da infiltração de amiloide, após o transplante hepático, avaliou o seu impacto na inervação autonómica cardíaca. Num pequeno grupo de 31 doentes franceses, Delahaye et al.12 compararam o índice C/M antes e após o transplante hepático e complementaram com a avaliação ecocardiográfica. De forma semelhante aos nossos resultados, não foi encontrada nenhuma alteração na inervação simpática após o transplante hepático durante um curto período de duração de seguimento (24±15 meses), apesar de a infiltração cardíaca de amiloide, traduzida pela espessura miocárdica, ter progredido. No presente estudo, que envolveu um grupo maior de 70 doentes transplantados, comparou‐se a taxa de decréscimo do índice C/M antes do transplante hepático (116 cintigrafias) com aquela dos exames efetuados posteriormente (100 cintigrafias). De forma relevante, verificou‐se estabilização de todos os parâmetros do MIBG após a cirurgia. Portanto, parece existir uma dissociação clara entre a deposição de amiloide (avaliada ecocardiograficamente pela espessura miocárdica) que poderá progredir, e o envolvimento dos nervos cardíacos autonómicos, que tende a estabilizar.
ConclusõesA desnervação cardíaca é relevante na progressão da PAF TTR‐V30M e avaliação do índice C/M tardio é importante para a estratificação do prognóstico destes doentes. O transplante hepático permite estabilizar a desnervação cardíaca. Após o transplante, a captação cardíaca de MIBG‐I123 permanece estável ao longo do tempo, sem recuperação ou deterioração adicional. Assim, é crucial que o transplante seja realizado numa fase suficientemente precoce da história natural da doença.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.