A taxa de sobrevivência dos doentes (dts) com cancro aumentou consideravelmente nas últimas décadas, havendo atualmente mais de 20 milhões de sobreviventes nos EUA e na Europa, números inimagináveis até há poucos anos. Para tal, muito contribuiu o aparecimento de novos fármacos (terapêuticas biológicas).
No entanto, estes benefícios na sobrevivência e o envelhecimento da população foram acompanhados de um aumento da taxa de efeitos adversos cardiovasculares, sobretudo se já havia doença cardíaca prévia. De facto, a incidência de cardiotoxicidade (CTX) tem sido continuamente mais evidente, comprometendo a eficácia das terapêuticas oncológicas (TO). São conhecidos os efeitos adversos cardíacos das TO tradicionais (antraciclinas e radioterapia torácica), como a insuficiência cardíaca. Contudo, esta representa apenas uma fração das manifestações de CTX, pois muitas das novas terapêuticas têm efeitos cardiovasculares diversos. As orientações clínicas existentes para fazer a deteção precoce, a prevenção e o tratamento da CTX dos tratamentos oncológicos, não abrangem todas as manifestações de CTX e ainda são poucas as ferramentas para a avaliação destes dts. A ecocardiografia é atualmente o método de escolha para avaliar os dts nas fases pré, durante e após a TO.
Dada a dimensão e relevância desta questão, faz todo o sentido falar de cárdio‐oncologia, uma nova subespecialidade médica. O número crescente de dts oncológicos com problemas cardíacos implica uma abordagem que deve ser partilhada entre cardiologistas, oncologistas e radioterapeutas.
Esta nova área do conhecimento médico deve também incluir uma componente formativa clínica, sendo também desejável a implementação de projetos de investigação clínicos e transacionais.
Considerable advances in cancer therapies in recent decades have reshaped the prognosis of cancer patients. There are now estimated to be over 20 million cancer survivors in the USA and Europe, numbers unimaginable a few years ago. However, this increase in survival, along with the aging of the patient population, has been accompanied by a rise in adverse cardiovascular effects, particularly when there is a previous history of heart disease. The incidence of cardiotoxicity continues to grow, which can compromise the effectiveness of cancer therapy. Cardiotoxicity associated with conventional therapies, especially anthracyclines and radiation, is well known, and usually leads to left ventricular dysfunction. However, heart failure represents only a fraction of the cardiotoxicity associated with newer therapies, which have diverse cardiovascular effects. There are few guidelines for early detection, prevention and treatment of cardiotoxicity of cancer treatments, and no well‐established tools for screening these patients. Echocardiography is the method of choice for assessment of patients before, during and after cancer treatment.
It therefore makes sense to adopt a multidisciplinary approach to these patients, involving cardiologists, oncologists and radiotherapists, collaborating in the development of new training modules, and performing clinical and translational research in a cardio‐oncology program. Cardio‐oncology is a new frontier in medicine and has emerged as a new medical subspecialty that concentrates knowledge, understanding, training and treatment of cardiovascular comorbidities, risks and complications in patients with cancer in a comprehensive approach to the patient rather than to the disease.
A doença cardiovascular e o cancro são responsáveis por cerca de 60% das causas de morte na chamada civilização ocidental. Em Portugal a situação não é diferente, mostrando os dados estatísticos do Instituto Nacional de Estatística referentes a 2013, que a principal causa de morte é cardiovascular (29,5%), seguida pelo cancro (24,3%)1.
Apesar disto, nas últimas décadas tem vindo a aumentar a taxa de sobrevivência de ambas as doenças, graças a extraordinários avanços nas terapêuticas que atualmente estão disponíveis. Nos EUA, a taxa de sobrevivência aos cinco anos dos doentes diagnosticados com cancro entre 1975‐1977 era de 50% e aumentou para 68% nos doentes diagnosticados entre 1999‐2005, havendo atualmente mais de 14 milhões de sobreviventes, números inimagináveis até há poucos anos2,3. Contudo, com uma sobrevivência maior, os efeitos adversos cardiovasculares mais tardios destas terapêuticas têm‐se tornado cada vez mais importantes.
Dada a dimensão e relevância desta questão, faz todo o sentido falar de cárdio‐oncologia como uma nova subespecialidade médica. O número crescente de doentes oncológicos com problemas cardíacos implica uma abordagem muito específica, que deve ser partilhada entre cardiologistas e oncologistas. Curiosamente, estas duas patologias têm fatores de risco em comum, como é o caso da obesidade e da diabetes mellitus e, não raramente, as duas patologias podem coexistir no mesmo doente.
A cardiotoxicidade é um efeito adverso frequente e conhecido de muitas terapêuticas oncológicas tradicionais (como as antraciclinas ou a radioterapia torácica), mas também pode ocorrer com os novos fármacos – as chamadas terapêuticas biológicas. A cardiotoxicidade pode afetar a sobrevivência e a qualidade de vida destes doentes, independentemente do seu prognóstico oncológico.
Os efeitos adversos cardiovasculares mais frequentes das terapêuticas oncológicas incluem: a disfunção ventricular esquerda sintomática e assintomática, a hipertensão arterial (HTA), as arritmias, QT prolongado, fenómenos tromboembólicos e a isquemia do miocárdio4,5.
Ao invés da cardiotoxicidade associada à terapêutica tradicional (tipo I), a cardiotoxicidade associada às novas terapêuticas biológicas tende a ser reversível (tipo II) com a suspensão da terapêutica (ex: trastuzumab)6,7, ou tratável com terapêutica médica como a HTA associada aos inibidores da angiogénese (ex: sunitinib; bevacizumab)8,9. Por outro lado, à medida que as estratégias terapêuticas vão evoluindo, é previsível que as terapêuticas tradicionais sejam associadas com uma ou mais das terapêuticas biológicas, aumentando a probabilidade de aparecimento de cardiotoxicidade.
Embora a cardiotoxicidade associada à terapêutica oncológica sistémica convencional esteja bem estabelecida, a cardiotoxicidade precoce e tardia das novas terapêuticas biólogicas não é ainda bem conhecida, como também não sabemos as potenciais consequências precoces e tardias das associações terapêuticas10. Consequentemente, é cada vez mais importante identificar biomarcadores precoces de envolvimento cardíaco11.
O objetivo deste artigo é fazer uma breve revisão do estado da arte e recomendar práticas de atuação clínica, que permitam melhorar a deteção precoce e o tratamento dos doentes com complicações cardiovasculares das terapêuticas oncológicas, através duma abordagem multidisciplinar numa consulta de cárdio‐oncologia.
Terapêuticas oncológicas farmacológicasAntraciclinasAs antraciclinas (doxorubicina, epirubicina, daunorubicina e idarubicina) estão entre os fármacos mais usados na quimioterapia e são particularmente eficazes no tratamento do cancro da mama e nos linfomas. Todavia, esta sua eficácia pode ser prejudicada pelo aparecimento de efeitos adversos cardíacos, nomeadamente a insuficiência cardíaca, que se pode manifestar numa fase precoce (semanas a meses) após a terapêutica ou mais tardiamente (vários anos depois).
Investigação recente demonstrou que as antraciclinas inibem seletivamente a expressão genética do músculo cardíaco. A doxorubicina liga‐se ao DNA intercalando‐se entre bases específicas, impedindo deste modo a síntese de DNA, RNA ou ambos, o que vai interferir com os processos de replicação e transcrição.
O efeito cardiológico das antraciclinas também está associado com a inibição da topoisomerase 2β e com a formação de radicais livres de oxigénio. Estas alterações na expressão genética podem originar a apoptose precoce dos cardiomiocitos e a perda progressiva de miofibrilhas da musculatura cardíaca12,13.
O principal fator de risco para o desenvolvimento de insuficiência cardíaca é a dose cumulativa das antraciclinas. A incidência de cardiotoxicidade sintomática com a doxorubicina varia entre 5% para doses de 400mg/m2 até 48% para doses cumulativas de 700mg/m214,15.
Estima‐se que mais de metade dos doentes que fizeram antraciclinas vão desenvolver alterações cardíacas nos seis anos subsequentes e têm uma probabilidade cinco vezes maior de vir a ter insuficiência cardíaca do que os doentes não tratados com este tipo de fármacos16.
Os outros fatores de risco incluem: as idades mais avançadas (>65 anos) ou mais jovens (<18 anos), género feminino, HTA, doença cardíaca prévia, diabetes e a irradiação torácica prévia. A terapêutica combinada com ciclofosfamida e taxanos, que é frequentemente usada no cancro da mama, pode potenciar o risco de cardiotoxicidade17.
TrastuzumabO tratamento com trastuzumab, um anticorpo monoclonal com alta afinidade para o recetor HER2, alterou a história natural das doentes com cancro da mama HER2 positivo, uma variante da doença que ocorre em cerca de 25% dos casos e que está associada com pior prognóstico. De facto, a utilização desta terapêutica melhorou a sobrevivência em 33% e diminuiu o risco de recorrências em cerca de 50% destas doentes18,19. Todavia, esta terapêutica está associada a cardiotoxicidade, tendo‐se verificado uma maior incidência de disfunção ventricular esquerda sintomática e assintomática, que pode variar entre 4% em contexto adjuvante e 27% em contexto metastático20.
Esta cardiotoxicidade tem características diferentes da cardiotoxicidade associada com as antraciclinas, uma vez que é independente da dose utilizada e não apresenta as alterações ultraestruturais típicas das antraciclinas.
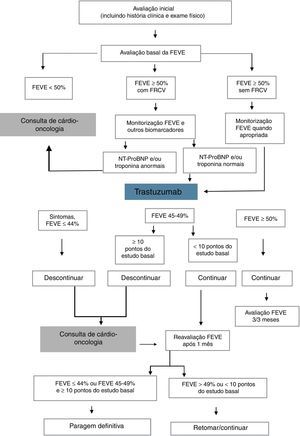
Têm sido propostas estratégias para reduzir a cardiotoxicidade das antraciclinas e do trastuzumab, que incluem a avaliação com biomarcadores como a troponina I e o NT‐ProBNP, a determinação ecocardiográfica da fração ventricular esquerda basal e a sua monitorização ao longo do tratamento, assim como a avaliação da deformação ventricular (com avaliação do strain longitudinal global) (Figura 1), que podem levar à necessidade de interrupção transitória ou definitiva da terapêutica oncológica e à instituição de terapêutica para a insuficiência cardíaca21–24.
Algoritmo de decisão para monitorização e deteção de cardiotoxicidade tipo I e tipo II antes e durante quimioterapia (adaptado de Rashi et al.60). FEVE: fração de ejeção ventricular esquerda.
A terapêutica deste tipo de cardiotoxicidade, caracterizada por disfunção ventricular esquerda, deve ser tratada com os mesmos fármacos usados na insuficiência cardiaca de outras etiologias, como os inibidores da enzima de conversão, os antagonistas da angiotensina II e os beta‐bloqueantes, como é preconizado pelas orientações clínicas europeias e americanas25–27.
Inibidores da angiogénese e hipertensão arterialInicialmente, o crescimento de um tumor é alimentado pelos vasos sanguíneos que lhe estão próximos. Quando o tumor atinge um determinado tamanho, esses vasos sanguíneos já não são suficientes e o tumor para continuar o seu processo de crescimento, adquire a capacidade de gerar novos vasos, processo conhecido por angiogénese. Assim, as células tumorais são capazes de aumentar os fatores pró‐angiogénicos, como o fator de crescimento do endotélio vascular (VEGF) e diminuir os fatores inibidores da angiogénese28–30.
A HTA é a toxicidade cardiovascular mais frequentemente associada com os inibidores do fator de crescimento do endotélio vascular (VEGFI).
Os mecanismos envolvidos na patogénese da HTA associada à terapêutica com os VEGFI são complexos e multifatoriais, e ainda não estão completamente esclarecidos. O VEGF é um vasodilatador que atua via produção de ácido nítrico, e a sua inibição origina vasoconstrição, aumento da resistência vascular periférica e HTA. Outros fatores mediados pelo VEGFI, como a disfunção endotelial, a remodelação vascular, a rigidez arterial e a rarefação dos vasos capilares, parecem também ter um contributo importante32–34. Mais recentemente, a endotelina 1 (ET1), um potente vasoconstritor, também tem sido implicada na génese da HTA mediada pelos VEGFI. A sua secreção parece estar aumentada devido à disfunção endotelial, havendo já evidência em estudos clínicos que níveis aumentados de ET1 aparecem em paralelo com subida da pressão arterial (TA) em doentes a fazer terapêutica com VEGFI35.
Praticamente quase 100% dos doentes tratados com VEGFI têm subida da tensão arterial, havendo um subgrupo que desenvolve HTA. O 1.° ciclo de tratamento com VEGFI é a fase em que se verifica o maior aumento da tensão arterial. A HTA induzida pelos VEGFI não é um efeito adverso da terapêutica, mas sim um mecanismo dependente da terapêutica on‐target. Este facto levou ao conceito de que a HTA poder ser um marcador da eficácia terapêutica dos VEGFI e uma resposta antiangiogénica positiva, e, como tal, ser um biomarcador de bom prognóstico desta terapêutica30–32.
Associado com o aumento da tensão arterial dose‐dependente está também um aumento do risco de proteinúria. Há mesmo um subgrupo de doentes que pode desenvolver doença glomerular ou a microangiopatia trombótica glomerular e insuficiência renal aguda, que são reversíveis com a suspensão imediata da terapêutica.
Nos doentes que desenvolvem HTA, pode haver também complicações neurológicas, como, por exemplo, a síndrome da leucoencefalopatia posterior, que é reversível com a descontinuação da terapêutica.
O aumento da TA induzida pelos VEGFI tem um perfil característico: acontece rapidamente, poucas horas depois do início da terapêutica, sendo TA sistólica mais afetada do que a diastólica. A incidência de HTA está relacionada com a dose e está aumentada com a utilização de múltiplos agentes antiangiogénicos usados em associação.
O objetivo da otimização da terapêutica anti‐hipertensora é permitir que a terapêutica dirigida com VEGFI seja administrada sem alteração de dose, de forma contínua e segura.
Para tal, é recomendável fazer uma avaliação cardiovascular basal antes de se iniciar estas terapêuticas, incluindo avaliação repetida da TA. É igualmente importante avaliar a função renal e a existência de proteinúria, pois o envolvimento renal pode ser responsável pelo aparecimento de HTA de novo ou agravamento de HTA pré‐existente. O objetivo não é excluir doentes, mas sim avaliar o risco basal e iniciar monitorização rigorosa. É importante manter ou iniciar terapêutica anti‐hipertensora para níveis de TA de 140/90mmHg. Estes níveis tensionais deverão ser ajustados de acordo com a existência de comorbilidades (130/80mmHg, se diabetes ou insuficiência renal crónica) (Tabela 1)33–36.
Gravidade da hipertensão arterial (HTA) e comparação das recomendações da Sociedade Europeia de Cardiologia (SEC)37 e do National Cancer Institute (NCI)38
| Grau NCI‐CTC v4.0 (2010) | Recomendações | Classificação SEC (2013) | Recomendações |
|---|---|---|---|
| 0 | Nenhuma | Ótima: <120/80mmHg Normal: 120‐129/80‐84mmHg | Nenhuma |
| 1 – Aumento assintomático, transitório (<24H)>20mmHg (diastólica) ou>150/100mmHg se TA previamente normal | Nenhuma | Normal/alta: 130‐139/85‐89mmHg | ‐ Modificação do estilo de vida se FR>1 |
| 2 – Aumento persistente, recorrente>20mmHg (diastólica) ou>150/100mmHg se TA previamente normal | Iniciar terapêutica anti‐hipertensora (monoterapia) | HTA grau 1: 140‐159/90‐99mmHg | ‐ Modificação do estilo de vida ‐ Iniciar terapêutica anti‐hipertensora se LOA, DM, IRC grau 3 (TA<140/90mmHg) |
| 3 – TA>160/100mmHg | Terapêutica anti‐hipertensora mais intensa | HTA grau 2: 160‐179/100/109mmHg | ‐ Modificação do estilo de vida ‐ Terapêutica anti‐hipertensora imediata se FR≥1 (TA<140/90mmHg) |
| 4 – HTA maligna, déficit neurológico transitório ou permanente, crise hipertensiva | Intervenção urgente | HTA grau 3: ≥180/110 | ‐ Modificação do estilo de vida ‐ Terapêutica anti‐hipertensora imediata: DCV sintomática, DM com LOA, IRC grau ≥4 (TA<140/90mmHg) |
DM: diabetes mellitus; IRC: insuficiência renal crónica; LOA: lesão órgão‐alvo; TA: tensão arterial.
Várias classes de fármacos anti‐hipertensores têm sido utilizados para tratar a HTA dos doentes oncológicos. Todos são eficazes, numa base individual, não havendo estudos que demonstrem superioridade de uma classe em relação a outra. Todavia, é importante ter cuidado com os antagonistas do cálcio não‐hidropiridínicos (verapamil e diltiazem), que também são inibidores da CYP 3A4. Como o ácido nítrico endotelial é considerado um putativo mediador da angiogénese, agentes que atuem no aumento do ácido nítrico como os nitratos ou o nebivolol têm sido recomendados no tratamento da HTA destes doentes33.
Uma vez iniciada a terapêutica, é recomendado fazer avaliação regular da TA durante o 1.° ciclo da terapêutica e depois a cada duas a três semanas durante a duração do tratamento, e os doentes devem ser aconselhados a fazer automedição em casa. A avaliação da TA poderá ser mais frequente, se os doentes estiverem a fazer medicação concomitante com fármacos que aumentem o risco de HTA, como os anti‐inflamatórios e a eritropoetina.
No caso de a TA sistólica subir para valores ≥200mmHg ou a diastólica para ≥100mmHg, deve‐se reduzir a dose ou suspender o tratamento oncológico. A ideia é manter a dose mais alta possível que o doente consiga tolerar.
O tratamento deve ter em conta a diminuição do risco a curto prazo associado com a HTA (acidente vascular cerebral, enfarte agudo do miocárdio, insuficiência cardíaca), enquanto deve assegurar a dose terapêutica eficaz do tratamento oncológico antiangiogénico.
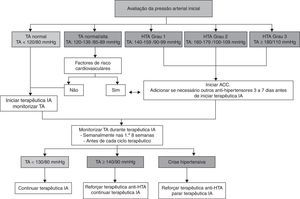
Não existem guidelines específicas para o tratamento da HTA induzida pelos VEGFI e, assim, a terapêutica deve basear‐se nas recomendações existentes da Sociedade Europeia de Cardiologia e do National Cancer Institute (Figura 2)37,38.
Avaliação inicial e monitorização da pressão arterial durante terapêutica com fármacos antiantiangiogénicos (adaptado de Ederhy et al.36).
ACC: antagonistas dos canais de cálcio; IA: inibidores da angiogénese.
A irradiação do coração aumenta o risco de cardiotoxicidade induzida pela radioterapia (RIHD) e está relacionada com a dose cumulativa. Pode ser potenciada pela quimioterapia, nomeadamente pelas antraciclinas. A dose cumulativa total é função do número de tratamentos e da dose da radiação. As manifestações da RIHD podem ser agudas; todavia, a maior parte só se manifesta clinicamente vários anos após o tratamento. Os seus efeitos adversos são múltiplos, podendo ocasionar insuficiência cardíaca, doença coronária, pericardites, valvulopatias e alterações do ritmo cardíaco. Além disso, a RIHD pode também ser potenciada pela existência de vários fatores de risco que são comuns às doenças cardíacas e oncológicas, como a obesidade, sedentarismo, diabetes, HTA e o tabagismo.
Está bem documentado o aumento dose‐dependente das doenças cardiovasculares após radioterapia torácica, especialmente nos linfomas e no cancro da mama (sobretudo da esquerda), e as doenças cardiovasculares são a causa não oncológica mais frequente de morte. De facto, comparando o risco‐benefício a longo prazo, o efeito positivo da radioterapia pode ser parcialmente anulado pelas complicações cardíacas39,40. No entanto, os dados conhecidos e reportados são em grande parte retrospetivos e num tempo em que ainda eram utilizados os protocolos antigos. Ainda não é conhecida a prevalência de RIHD com a utilização dos novos protocolos da radioterapia, que incluem o planeamento por tomografia tridimensional da área a irradiar, com proteção cardíaca, redução das doses e do tamanho do campo de irradiação. Por exemplo no cancro da mama, o planeamento por tomografia é feito de forma a não incluir o coração no campo de intervenção; também a exclusão da cadeia linfática mamária interna do campo permite reduzir as doses cardíacas. Outro fator potencial é o fracionamento das doses de radiação, havendo alguns estudos que demonstraram que, com maior fracionamento da dose total, havia menor incidência de pericardite aguda e necrose do miocárdio.
Com estes novos protocolos espera‐se diminuir a incidência de RIHD, embora ainda não haja dados de seguimento a longo prazo.
A radiação ionizante pode lesar praticamente todas as estruturas cardíacas. As alterações no sistema vascular ocorrem a nível micro e macrovascular. A nível microvascular, traduzem‐se em perda de células endoteliais com subsequente resposta inflamatória, lesão vascular e isquemia. O aparecimento de fibrose parece estar relacionado com o processo de reparação celular e não com o efeito ionizante direto. As alterações macrovasculares incluem a arteriosclerose acelerada e a obstrução das artérias coronárias, ocasionando síndromes coronárias agudas em idades mais jovens.
A fibrose difusa após radioterapia, que se pode identificar histologicamente tanto no miocárdio como no pericárdio, pode ocasionar miocardite restritiva e pericardite constritiva41–44.
Não existem guidelines para a monitorização cardíaca destes doentes. Para minimizar os riscos de RIHD, os doentes de alto risco para eventos cardíacos devem ser identificados antes de iniciar a radioterapia e, quando apropriado, fazerem avaliação da função cardíaca, que deverá depois ser repetida ao longo do período de sobrevida.
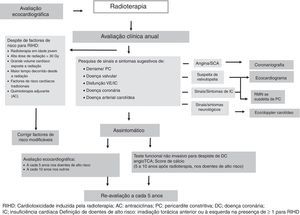
Os doentes que já foram submetidos a radioterapia torácica é recomendável que façam reavaliação da função cardíaca a cada dez anos. Este intervalo de tempo pode ser reduzido para cinco anos nos doentes considerados de alto risco para RIHD (Figura 3)45,46.
Algoritmo para avaliação após radioterapia torácica (adaptado de Lancelloti et al.46).
AC: antraciclinas; DC: doença coronária; IC: insuficiência cardíaca; PC: pericardite constritiva; RIHD: cardiotoxicidade induzida pela radioterapia;
Um programa de cárdio‐oncologia deverá estar assente em três pilares: 1 – componente clínica – consulta de cárdio‐oncologia; 2 – componente formativa; 3 – componente de investigação.
Consulta de cárdio‐oncologiaObjetivos- ‐
Providenciar cuidados especializados cardiológicos a doentes com cancro e antecedentes de doença cardiovascular, ou que desenvolveram complicações cardíacas durante as terapêuticas oncológicas.
- •
Otimizar os cuidados cardíacos em doentes oncológicos sob terapêutica potencialmente cardiotóxica.
- •
Melhorar o conhecimento das complicações cardíacas dos tratamentos oncológicos.
- •
Agilizar a deteção precoce de cardiotoxicidade (com biomarcadores clínicos, laboratoriais e imagiológicos, tendo a ecocardiografia um papel primordial) e estabelecer estratégias de intervenção para otimizar os cuidados cardiológicos.
- •
Otimizar o prognóstico dos doentes através duma abordagem multidisciplinar e integrativa de vários profissionais de saúde (médicos, enfermeiros, técnicos).
- •
Nesta consulta, os protocolos de monitorização da cardiotoxicidade devem incluir as três etapas intervencionais (Tabela 2): avaliação dos doentes antes do início da terapêutica oncológica, nomeadamente nos doentes com fatores de risco cardiovasculares; avaliação durante a terapêutica, no sentido de detetar e tratar precocemente as complicações cardiovasculares; e monitorização após o tratamento, como se ilustra nas Tabelas 3 e 4. A utilização destes scores de risco permite selecionar de forma mais rigorosa quais os doentes que devem ser referenciados à consulta de cárdio‐oncologia (Tabela 5).
Etapas intervencionais na vigilância de eventos cardíacos durante a terapêutica oncológica
| Etapa pré‐intervencional |
| Avaliação de risco |
| Identificação e controlo de fatores de risco cardiovasculares |
| Personalizar terapêutica oncológica, minimizando os riscos cardiovasculares |
| Etapa intervencional |
| Deteção precoce de cardiotoxicidade |
| Identificação e controlo de fatores de risco cardiovasculares |
| Etapa pós‐intervencional |
| Monitorização de sintomas e avaliação programada cardiovascular |
| Controlo de fatores de risco cardiovasculares |
Avaliação do score de risco de cardiotoxicidade, de acordo com os fármacos oncológicos utilizados e os fatores de risco dos doentes
| Risco relacionado com fármaco | Fatores de risco relacionados com o doente |
|---|---|
| Alto (score4) Antraciclinas; ciclofosfamida; herceptin | ‐ Idade:<15 ou>65 anos ‐ Género: feminino ‐ Comorbilidades: HTA; diabetes mellitus ‐ Antecedentes de miocardiopatia; insuficiência cardíaca; doença coronária; doença arterial periférica ‐ Quimioterapia prévia |
| Intermédio (score2) Docetaxel; pertuzumab; sunitinib; sorafenib | |
| Baixo (score1) Bevacizumab; desatinib; imatinib; lapatinib | |
| Raro (score0) Etoposido; rituxumab; talidomida |
Score de risco: risco relacionado com o doente+n.° de fatores de risco do doente (>6 – risco muito alto; 5‐6 – alto risco; 3‐4 – risco intermédio; 1‐2 – risco baixo; 0 – risco muito baixo).
Recomendações para a vigilância de cardiotoxicidade durante a etapa intervencional
| Risco de cardiotoxicidade | Doentes | Monitorização |
|---|---|---|
| Alto risco | Doença cardíaca estrutural ou FEVE muito diminuída | ‐ Seguimento em consulta de cárdio‐oncologia ‐ Só excecionalmente fazem terapêutica com potencial cardiotóxico |
| Risco intermédio | Fatores de risco cardiovasculares com FEVE>40% | Avaliação basal: ‐ ECG; análises sanguíneas (creatinina; HbA1c; lipídos) ‐ Troponina; NT‐ProBNP ‐ Ecocardiograma (FEVE; strain) Avaliação durante tratamento: ‐ Troponina em cada ciclo ‐ Ecocardiograma (FEVE; strain) ‐ Ponderar iniciar terapêutica cardiovascular (beta‐bloqueante; IECA; estatinas) Avaliação a longo prazo: ‐ ECG+ecocardiograma (+strain) +troponina+NT‐ProBNP no final do tratamento, após seis e 12 meses e depois cada 3‐4 anos |
| Baixo risco | Assintomático; sem fatores de risco cardiovasculares e sem doença cardíaca estrutural | Avaliação basal: ‐ ECG; análises sanguíneas (creatinina; HbA1c; lípidos) ‐ Troponina; NT‐ProBNP ‐ Ecocardiograma (FEVE; strain) Avaliação de seguimento: ‐ ECG+ecocardiograma (FEVE; strain) no final do tratamento |
Adaptado de Fernandez et al.50
Critérios para referenciação para consulta de cárdio‐oncologia
| Referenciação para consulta de cárdio‐oncologia |
|---|
| Doentes estratificados como risco alto e intermédio para otimização da terapêutica: (IECA; BB; estatinas) |
| Tratamento prévio com doxorubicina≥300mg/m2 e/ou radioterapia do mediastino≥30Gy |
| Doença cardíaca estrutural, insuficiência cardíaca, doença coronária ou arritmias |
| HTA não controlada, dislipidemia ou diabetes mellitus |
| Alterações no ECG ou no ecocardiograma basal ou no seguimento: |
| Descida da FEVE>10% com FEVE basal ≥55% |
| SLG anormal (>‐19%) ou descida>15% |
| Troponina positiva |
| Dor retroesternal, dispneia, síncope, arritmias |
| HTA refratária à terapêutica |
BB: beta‐bloqueante; FEVE: fração de ejeção ventricular esquerda; IECA: inibidores da enzima de conversão da angiotensina; SLG: strain longitudinal global.
Para a monitorização e deteção precoce da cardiotoxicidade, é igualmente importante desenvolver algoritmos apropriados, fáceis de utilizar e implementar na prática clínica, como alguns dos já descritos43–49.
Finalmente, deve ser feito controlo contínuo de qualidade, podendo ser utilizado o método planear/desenvolver/conferir/atuar (PDCA).
Estes indicadores irão permitir analisar a qualidade técnica e científica (decisões terapêuticas; avaliação dos outcomes); o perfil de segurança e grau de satisfação dos doentes (através de questionários de satisfação; recomendações para combater fatores de risco; ensino ao doente); e fazer registos, protocolos de estudo, planos de formação pré e pós‐graduada55.
Componente formativaEsta nova área do conhecimento médico deve também incluir, como preconiza a Sociedade Europeia da Cardiologia, uma componente formativa quer no ensino pré‐graduado quer no ensino pós‐graduado.
Seria de todo o interesse haver no internato de ambas as especialidades um período de formação dedicado à cárdio‐oncologia (nível básico ou mais avançado, de acordo com as opções individuais)50–58.
Componente de investigaçãoFinalmente, é também desejável a implementação de projetos de investigação clínicos e translacionais, que permitam a identificação precoce de cardiotoxicidade, assim como a suscetibilidade individual para desenvolver cardiotoxicidade.
A cardiotoxicidade é cada vez mais causa de preocupação nos ensaios clínicos e pré‐clínicos com novos fármacos. Estes efeitos adversos não raramente são causa de suspensão da terapêutica oncológica. Como tal, existe necessidade crescente de prever, com maior precisão, o risco de cardiotoxicidade induzida por estes novos fármacos em estádios precoces da sua investigação59–61.
ConclusãoAs taxas de sobrevivência dos doentes com cancro têm vindo a aumentar graças às novas terapêuticas oncológicas. Todavia, esta enorme conquista pode ser ensombrada pelos efeitos deletérios destas terapêuticas no sistema cardiovascular. Esta cardiotoxicidade pode manifestar‐se de forma aguda ou, mais tardiamente, meses ou anos após terminar a terapêutica. Podem ainda exacerbar ou até desmascarar problemas cardíacos pré‐existentes.
O aparecimento de doença cardiovascular durante a terapêutica oncológica pode levar a alteração do esquema terapêutico (alteração de dose, duração de ciclos, interrupção transitória ou definitiva da terapêutica) e, portanto, impedir a sua total eficácia.
A nova disciplina de cárdio‐oncologia surgiu em resposta à necessidade de detetar precocemente envolvimento cardiovascular e otimizar o tratamento cardiológico dos doentes com cancro, quer durante a terapêutica oncológica, quer a longo prazo nos sobreviventes. A importância da abordagem multidisciplinar tem vido a ser reconhecida por várias sociedades e organizações europeias e americanas, e deve tornar‐se standard no seguimento destes doentes. Esta colaboração estreita entre especialidades servirá também para estabelecer recomendações clínicas, protocolos de investigação clínica e translacional que permitam responder a questões como prever, prevenir e tratar a cardiotoxicidade.
Conflito de interessesOs autores declaram não haver conflito de interesses.