A influência do sistema nervoso autónomo (SNA) na génese da fibrilhação auricular (FA) envolve múltiplos mecanismos complexos com impacto nas propriedades eletrofisiológicas cardíacas. A importância dos efeitos da estimulação autonómica no substrato elétrico auricular e das veias pulmonares (VP) e na vulnerabilidade para FA requer melhor compreensão.
ObjetivoAvaliar os efeitos da estimulação vagal (estim_vag) e simpática (estim_simp) aguda na condução e refratariedade das aurículas e VP e na indutibilidade de FA no coração de coelho in vivo com inervação autonómica preservada.
MétodosEstudámos 17 coelhos New Zealand de ambos os sexos. Para abordagem de «toráx-aberto» procedeu-se a anestesia, entubação e ventilação após bloqueio neuro-muscular. O ECG foi obtido a partir de 3 derivações dos membros. Os eletrogramas foram registados com 4 elétrodos monopolares colocados na superfície epicárdica, distribuídos ao longo das aurículas e com um elétrodo circular adaptado à porção proximal das VP. Estimulou-se o nervo vago cervical direito e o tronco simpático torácico com elétrodos bipolares de platina. Estudámos os períodos refratários efetivos (PRE) e a condução elétrica auricular, entre a aurícula direita lateral-alta (AD) e a aurícula esquerda lateral-alta (AE), e entre AD e VP, em condições basais e durante estim_vag, estim_simp e estimulação autonómica combinada (dual_estim). Para indução de FA, procedeu-se a pacing rápido (50Hz, 10s, isolado ou com estim_vag, estim_simp ou dual_estim) com elétrodo bipolar no apêndice auricular direito (AAD), apêndice auricular esquerdo (AAE) e VP.
ResultadosEm condições basais: os PRE eram maiores no AAE e registou-se um atraso na ativação da AD para as VP, comparando com a condução interauricular. Durante estim_vag ou dual_estim: os PRE encurtaram significativamente em todos os locais, o intervalo de condução interauricular variou de 20±4ms para 30±10ms (p<0,05) e 31±11ms (p<0,05), respetivamente. Com estim_simp obteve-se uma redução significativa dos PRE no AAE e do tempo de condução interauricular para 16±11ms (p<0,05). Induziu-se FA em 35 a 53% dos animais com 50Hz, 65 a 76% com estim_vagal ou estim_simp, e 75 a 100% com dual_estim (p<0,05). A duração da FA aumentou significativamente durante estim_vagal e/ou estim_simp. Em 2/3 dos animais com indução de FA com duração >10s a arritmia terminou imediatamente após interrupção da estim_vagal.
ConclusõesNo coração de coelho inervado in vivo, a estimulação autonómica aguda encurta a refratariedade auricular e das VP, e modifica a velocidade de condução auricular, potenciando a indução e duração de FA. Os resultados sugerem que as variações agudas e a interação da atividade autonómica podem desempenhar um papel importante na fisiopatologia da FA.
Atrial fibrillation (AF) is a complex disease with multiple mechanisms, involving the interaction between the autonomic nervous system (ANS), electrophysiological properties of the atria and pulmonary veins (PVs), and vulnerability for AF.
AimWe assessed the effects of acute vagal (vagus_stim) and sympathetic stimulation (symp_stim) on atrial conduction, atrial and PV refractoriness and inducibility of AF in an in vivo rabbit model with preserved autonomic innervation.
MethodsAn open-epicardial approach was used in 17 anesthetized and artificially ventilated New Zealand white rabbits. The ECG was recorded with bipolar subcutaneous electrodes placed in the four limbs. Electrograms were obtained with four monopolar electrodes placed epicardially along the atria, and a circular electrode adapted to the proximal PVs. The cervical vagus nerve and thoracic sympathetic trunk were stimulated with bipolar electrodes. Epicardial activation was recorded in sinus rhythm, and effective refractory periods (ERPs) and conduction times from the high-lateral right atrium (RA) to the high-lateral left atrium (LA) and PVs were quantified at baseline and during vagus_stim, symp_stim, or combined vagal and sympathetic stimulation (dual_stim). Burst pacing (50Hz, 10s), alone or combined with vagus_stim, symp_stim or dual_stim, was performed in the right (RAA) and left atrial appendage (LAA) and PVs to test for AF inducibility.
ResultsAt baseline, ERPs were higher in the LAA and there was a delay in the conduction time from RA to PV, compared to the mean activation time from RA to LA. During vagus_stim or dual_stim, ERP decreased significantly at all sites, and baseline interatrial activation times changed from 20±4ms to 30±10ms and 31±11ms, respectively (p<0.05). Symp_stim resulted in a significant decrease in ERPs only in the LAA, and a reduction of the interatrial interval to 16±11ms (p<0.05 vs baseline). AF inducibility ranged from 35% to 53% with baseline 50Hz pacing, 65% to 76% during vagus_stim or symp_stim, and 75% to 100% with dual_stim (p<0.05). AF duration increased significantly during ANS stimulation. In two-thirds of the animals with longer inducible AF, the arrhythmia ceased immediately after cessation of vagus_stim.
ConclusionsIn the fully innervated rabbit heart in vivo, acute ANS stimulation shortens atrial and PV refractoriness, and significantly changes atrial conduction times, promoting AF induction and prolonging the arrhythmia. This underscores the importance of acute variations in ANS tone and its interactions in the pathophysiology of AF.
A fibrilhação auricular (FA) é uma arritmia complexa envolvendo múltiplos mecanismos que, apesar dos desenvolvimentos recentes alcançados na abordagem terapêutica desta arritmia, não estão completamente esclarecidos. A FA isolada relaciona-se, provavelmente, com um substrato eletrofisiológico envolvendo a contribuição de atividade automática focal, proveniente sobretudo das veias pulmonares (VP), e múltiplas ondas de despolarização simultâneas que se propagam e interagem na superfície auricular1–4. Tem sido sugerido que a atividade do sistema nervoso autónomo (SNA) possa influenciar as propriedades eletrofisiológicas das aurículas, atuando como um modulador na fisiopatologia da FA4–6. De facto, o tónus autonómico pode facilitar a ocorrência de arritmias de reentrada e a atividade trigger4,5,7. Estudos clínicos sugerem que a inervação simpática e parassimpática podem ser importantes na génese da FA, havendo evidência de que os episódios de FA paroxística são frequentemente precedidos por flutuações do balanço autonómico8–10. Trabalhos experimentais também têm contribuído para melhorar a compreensão da influência arritmogénica do SNA nos mecanismos subjacentes à FA11–16. No modelo do cão foi sugerido que as arritmias auriculares eram causadas por alterações da atividade autonómica e sua influência nas VP e veia cava superior13. No mesmo modelo, a estimulação simpática e vagal foi também capaz de encurtar os períodos refratários efetivos (PRE) auriculares e facilitar a ocorrência de circuitos de reentrada17. Além disso, a distribuição heterogénea da inervação autonómica a nível das aurículas pode contribuir para o substrato associado à FA, particularmente na ausência de anomalias estruturais17. Foi também demonstrado que a estimulação dos plexus ganglionares cardíacos, que modulam a inervação autonómica, provoca libertação local de neurotransmissores do simpático e parassimpático que podem aumentar o automatismo e encurtar a duração do potencial de ação e refratariedade locais15. Recentemente, no modelo do cão, num trabalho com registo direto da atividade autonómica eferente, demonstrou-se que as descargas simultâneas simpático-vagais são frequentemente o fator iniciador de taquicardia auricular paroxística e de FA após um período de pacing auricular esquerdo de alta-frequência18. Embora se reconheça que o SNA possa desempenhar um papel importante na fisiopatologia da FA, permanece por esclarecer qual o impacto (isolado ou em combinação) da atividade simpática e/ou vagal na arritmogénese das aurículas e sua implicação na génese, manutenção e interrupção da FA. Têm sido desenvolvidos vários modelos animais para caracterizar os efeitos eletrofisiológicos da estimulação autonómica, de forma a contribuir para a compreensão dos mecanismos complexos subjacentes à FA. No entanto, uma parte importante desta atividade experimental tem sido levada a cabo em modelos de coração isolado. É reconhecida a necessidade de esclarecer a relação entre a ativação autonómica aguda in vivo e a vulnerabilidade para iniciar e manter a FA, nomeadamente porque a modificação da inervação autonómica, sobretudo em áreas cardíacas com grande densidade de terminações nervosas, pode ter implicações potenciais na terapêutica ablativa da FA14,19,20.
No presente estudo, foi avaliada a influência da estimulação aguda simpática e vagal na condução e refratariedade das aurículas e VP, bem como na indução e duração de FA, numa preparação de coração de coelho com inervação autonómica preservada.
Material e métodosPreparação do modelo animalForam utilizados coelhos New-Zealand brancos de ambos os sexos (n=17, 3,0-4,9kg), anestesiados com pentobarbital sódico (60mg/kg, i.v.). Através duma traqueostomia foi colocada uma cânula abaixo da laringe para ventilação intermitente com pressão positiva e mistura de ar com O2 (modelo 607, Harvard Apparatus, Reino Unido; 60 ciclos/min) após bloqueio neuromuscular (vecuronium 0,05mg/kg/h, i.v.), para assegurar o controlo da frequência e do volume respiratórios. O grau de anestesia foi avaliado com base na monitorização da pressão arterial (PA), frequência cardíaca (FC) e atividade respiratória, utilizando-se doses suplementares dos fármacos para manter um efeito estável da anestesia geral. A artéria femural foi canalizada para monitorização contínua da PA (transdutor SensoNor 840) e a veia femural usada para administração de solução salina a 0,9% e fármacos. A bexiga foi cateterizada e drenada. A temperatura retal foi mantida a ∼38°C com recurso a uma placa de aquecimento colocada debaixo do animal (Harvard Apparatus, Reino Unido). O registo de ECG obteve-se com elétrodos bipolares subcutâneos colocados nos quatro membros, com amplificação e filtragem do sinal. O ECG, a PA e os eletrogramas foram continuamente monitorizados num polígrafo (Lectromed, Hertfordshire, Reino Unido) e analisados em computador (PowerLab, ADInstruments).
O animal anestesiado era colocado em decúbito ventral para exposição da porção dorsal do tórax, procedendo-se a uma incisão ao nível das vértebras C6-T2, utilizando eletrocautério e um afastador automático para acesso à vértebra T1, submetida a perfuração com broca de 2mm até abertura da dura mater espinhal. Após posicionamento em decúbito dorsal, identificava-se o nervo vago cervical direito através de incisão na linha mediana do pescoço, seguindo-se o seu isolamento e preparação para estimulação elétrica bipolar com elétrodos de platina, com isolamento por parafina semissólida. Uma ligeira rotação permitia inserir um elétrodo bipolar através do canal espinhal com recurso a micromanipulador (WPI, M330), para estimulação do fluxo simpático torácico ao nível de T1, que inclui sobretudo fibras pré-ganglionares para o gânglio estrelado21. Os elétrodos para estimulação do nervo vago e tronco simpático foram conectados a um estimulador programável de múltiplos canais (Master8, AMPI, Israel). O nervo vago foi estimulado (20Hz, duração do impulso - 2ms), com a amplitude ajustada para induzir uma diminuição da FC de ≈50%, e a estimulação simpática (3Hz, duração do impulso - 1ms) testada para obter um aumento da FC e da PA.
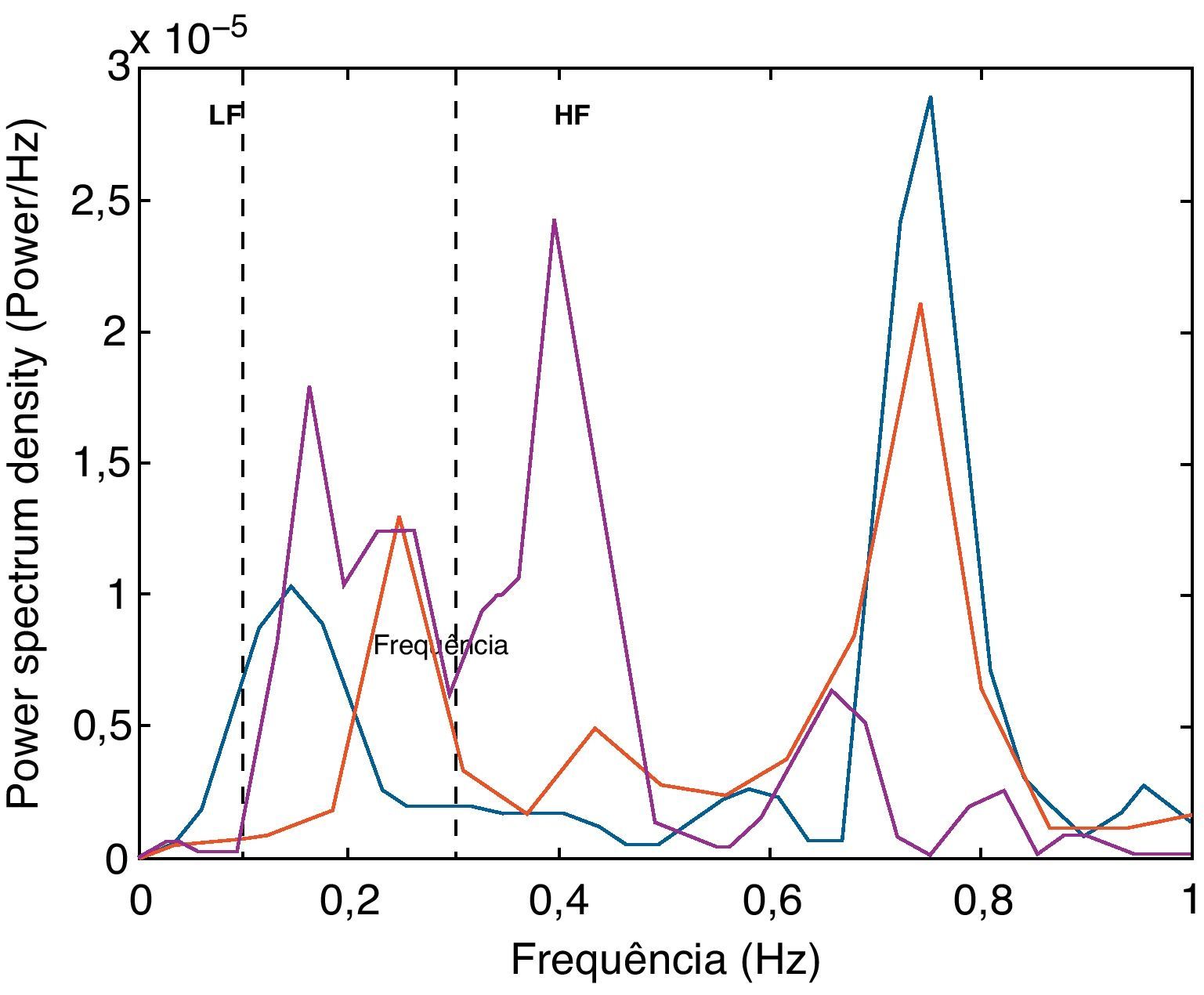
Além da monitorização da FC e PA, registámos séries de 30 segundos de intervalos RR para análise espectral com Transformada de Fourier (Fast Fourier Transform), com recurso a software MatLab (MathWorks, Natick, MA, EUA) em ambiente Origin (OriginLab, Origin Lab Corporation, Northampton, MA, EUA), para confirmação da estimulação autonómica, de acordo com descrição prévia22,23. A frequência espectral foi dividida em três componentes: VLF (very low- frequency; 0,01-0,1Hz), LF (low-frequency; 0,1-0,3Hz) e HF (high-frequency; 0,3-1Hz). Os valores da banda HF foram atribuídos à modulação vagal e os da banda LF consideraram-se como refletindo a atividade simpática.
Procedemos a esternotomia mediana e abertura do pericárdio para exposição do coração e abordagem eletrofisiológica epicárdica das aurículas e VP. Depois da toracotomia, manteve-se uma pressão final expiratória de 1-2cmH2O.
As experiências foram efetuadas em conformidade com as recomendações do «Guide for the Care and Use of Laboratory Animals», publicado pelo National Institute of Health, e mediante aprovação pela Comissão de Ética da Faculdade de Medicina de Lisboa.
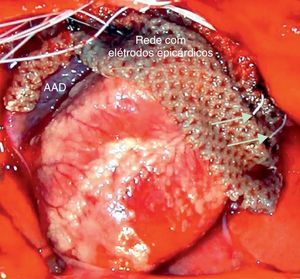
Protocolo eletrofisiológicoOs eletrogramas foram registados com quatro elétrodos monopolares (125-μm Ag-AgCl, isolados com Teflon), colocados numa rede de nylon com espaçamento interelétrodos de 4mm e aplicados em posição epicárdica, da aurícula direita lateral-alta (AD) à aurícula esquerda lateral-alta (AE) (Figura 1). Um elétrodo de ponta circular (cabo coaxial) foi posicionado envolvendo o segmento proximal das VP esquerdas para estimulação e registo de eletrogramas. Os eletrogramas foram amplificados e filtrados de 0,5 a 300Hz e de 30 a 250Hz para registos monopolares e bipolares, respetivamente (Neurolog, Digitemer, Reino Unido). No final do procedimento os animais foram sacrificados com uma overdose de anestésico.
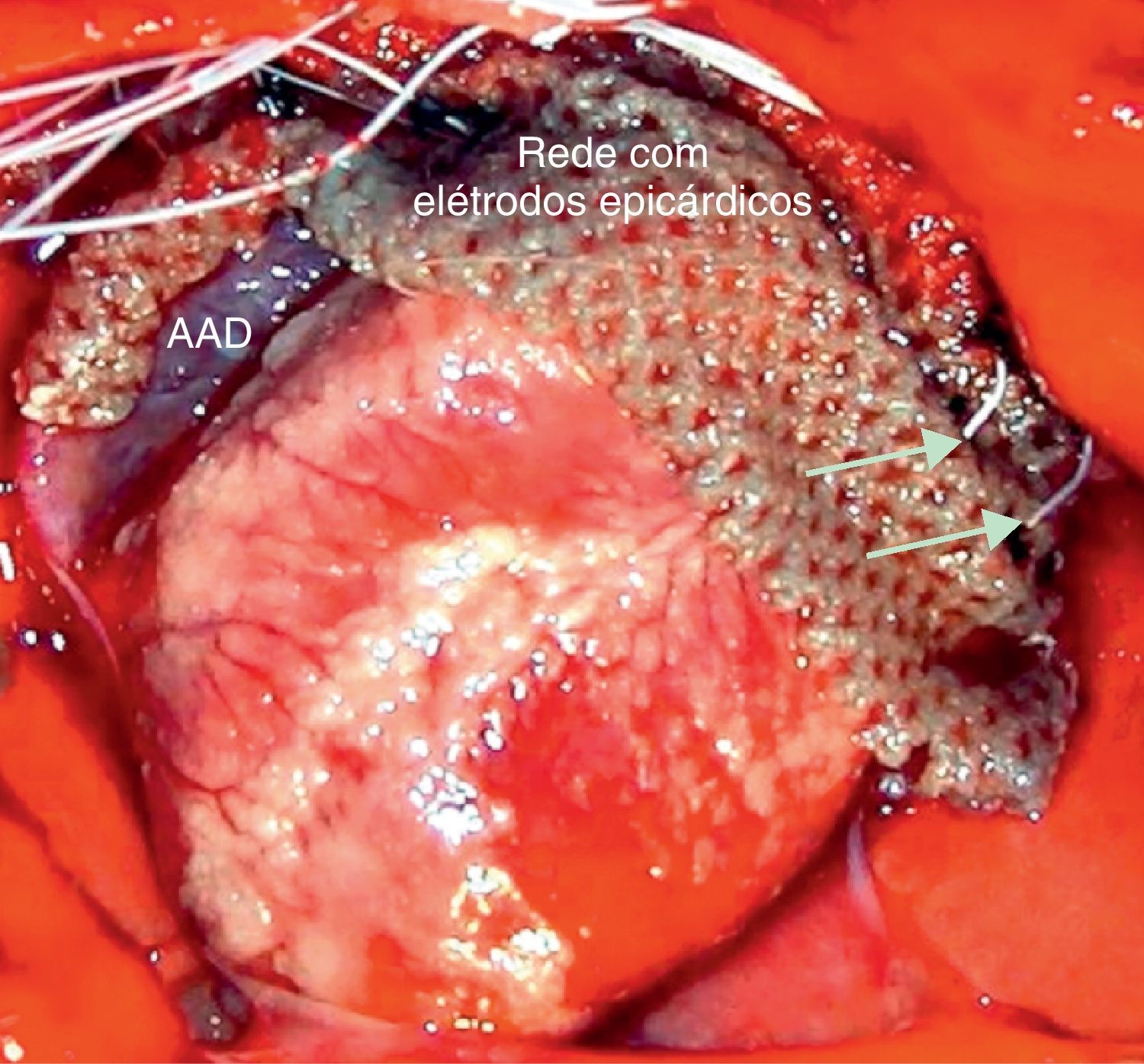
Preparação de tórax-aberto do coração de coelho com rede de nylon suportando elétrodos monopolares epicárdicos da aurícula direita lateral-alta até à aurícula esquerda lateral-alta. As setas indicam dois elétrodos com contacto epicárdico na aurícula esquerda. AAD=apêndice auricular direito.
A ativação epicárdica foi registada em ritmo sinusal, com análise dos tempos de condução interauricular (entre a AD e a AE) e da AD até à despolarização das VP, em condições basais e durante estimulação vagal, simpática ou simpático-vagal simultânea. A estimulação para estudo dos PRE e indução de FA foi efetuada com elétrodo bipolar (0,1mm, prata com isolamento de teflon) posicionado com micromanipulador (WPI, M330) no apêndice auricular direito (AAD) e apêndice auricular esquerdo (AAE), e com elétrodo circular nas VP. Em condições estáveis, procedeu-se a protocolo de estimulação programada (programador Master8, AMPI, Israel), com um extraestímulo durante pacing bipolar contínuo com ciclo de 300ms (ou 20ms inferior ao intervalo RR para FC >200 bpm). Utilizámos impulsos com duração de 1ms e o dobro da intensidade do limiar de captura. O extraestímulo foi introduzido com intervalo de acoplamento 100ms inferior ao do ciclo de base, diminuindo-se depois em intervalos de 5ms até atingir o PRE. O PRE foi definido como o intervalo S1-S2 mais longo com falha de despolarização local. Os intervalos de condução e os PRE foram analisados em condições basais e durante estimulação vagal, simpática ou combinada. Para avaliação da vulnerabilidade para indução de FA foi utilizado pacing de alta-frequência (50Hz, 10s, intensidade supralimiar), com elétrodo bipolar posicionado no AAD, AAE e VP, isolado ou combinado com estimulação vagal, simpática ou simpático-vagal. O protocolo de indução foi aplicado até três vezes em cada local de estimulação. Definiu-se FA como um ritmo auricular rápido desordenado, com ciclo, polaridade, configuração e amplitude variáveis e duração superior a cinco ciclos24. A duração da FA foi avaliada em cada uma das condições experimentais consideradas.
Análise estatísticaAs variáveis contínuas foram expressas sob a forma de média±desvio padrão e as variáveis categóricas em frequências e percentagens. As comparações foram efetuadas pelo teste de ANOVA e teste t de Student para as variáveis contínuas. O teste de Kolmogorov-Smirnov foi utilizado para avaliar a normalidade da distribuição das variáveis contínuas. A análise comparativa dos valores dos PRE e intervalos de condução basais e durante estimulação autonómica foi efetuada com o teste t de Student emparelhado. Para as variáveis categóricas usámos o teste de χ2, com correção de Yates. Considerámos estatisticamente significativos os resultados com valor<0,05. O programa estatístico utilizado foi o GraphPAD (GraphPad Software, Inc., California, EUA).
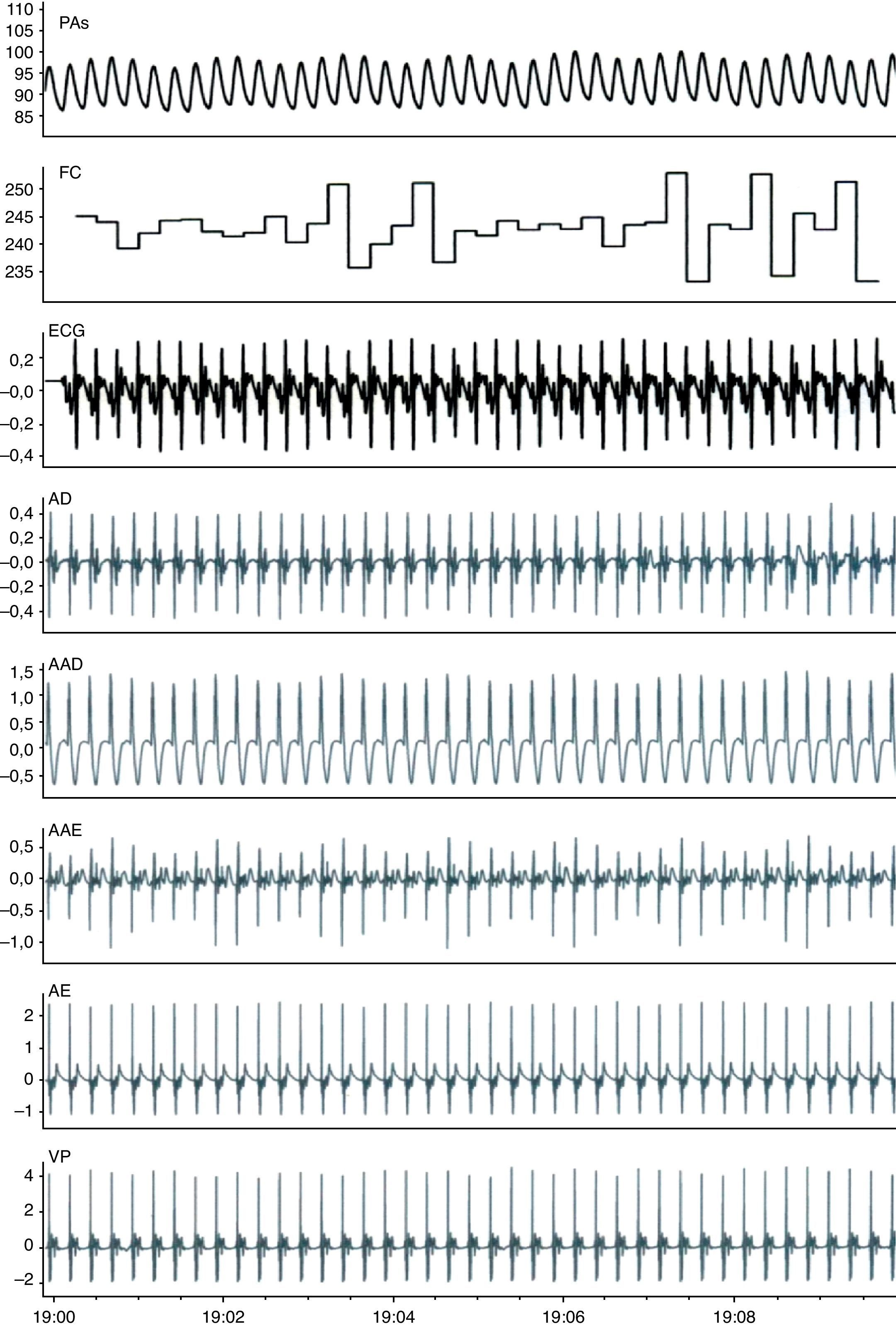
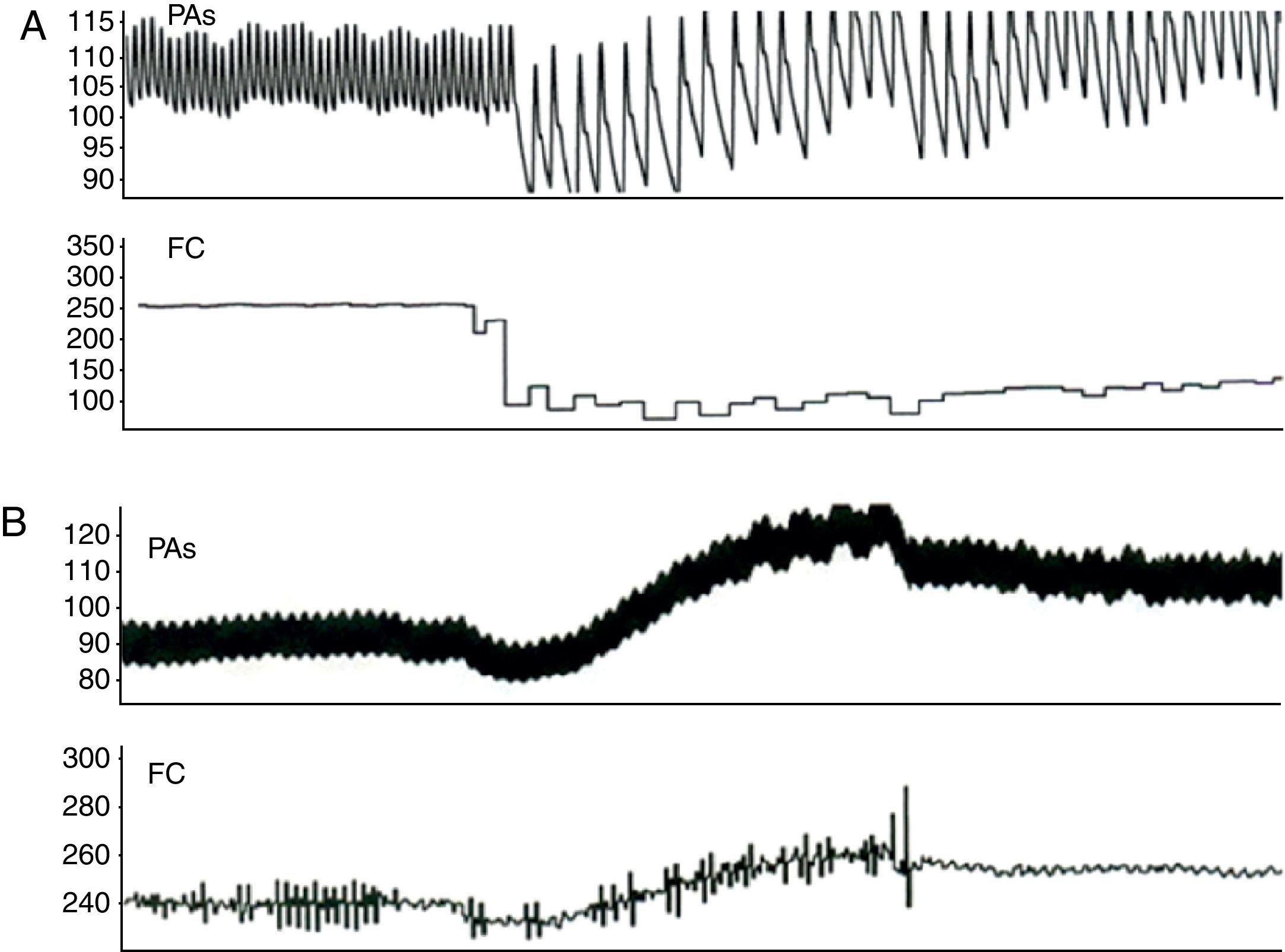
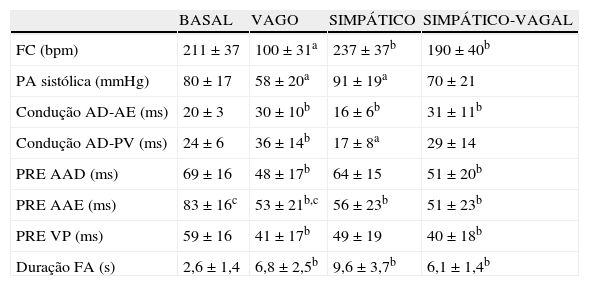
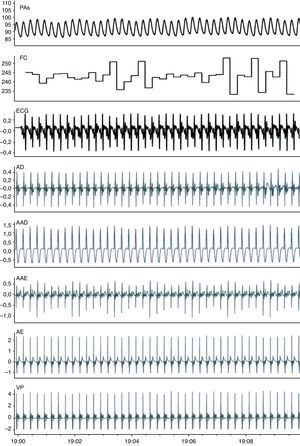
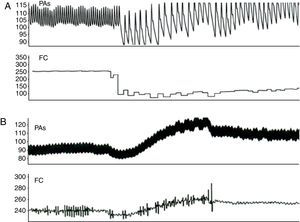
ResultadosA Figura 2 mostra os registos de monitorização obtidos em condições basais. Após preparação do animal, a FC média era de 211±37 bpm (190-230 bpm) e a PA sistólica de 80±17mmHg (65-90mmHg). A estimulação vagal causou uma diminuição significativa da FC (de 214±30 bpm para 100±31 bpm, p<0,01) e da PA (de 79±23mmHg para 58±20mmHg, p<0,01) (Figura 3, Tabela 1). A estimulação pré-ganglionar simpática induziu um ligeiro aumento da FC (de 210±34 bpm para 237±37 bpm, p<0,05) e da PA (75±13mmHg para 91±19mmHg, p<0,01) (Figura 3, Tabela 1). Após cessação da estimulação autonómica a FC a PA retomaram os valores pré-estimulação.
Efeito da estimulação autonómica na frequência cardíaca, pressão arterial sistólica, parâmetros eletrofisiológicos e inducibilidade de fibrilhação auricular
| BASAL | VAGO | SIMPÁTICO | SIMPÁTICO-VAGAL | |
| FC (bpm) | 211±37 | 100±31a | 237±37b | 190±40b |
| PA sistólica (mmHg) | 80±17 | 58±20a | 91±19a | 70±21 |
| Condução AD-AE (ms) | 20±3 | 30±10b | 16±6b | 31±11b |
| Condução AD-PV (ms) | 24±6 | 36±14b | 17±8a | 29±14 |
| PRE AAD (ms) | 69±16 | 48±17b | 64±15 | 51±20b |
| PRE AAE (ms) | 83±16c | 53±21b,c | 56±23b | 51±23b |
| PRE VP (ms) | 59±16 | 41±17b | 49±19 | 40±18b |
| Duração FA (s) | 2,6±1,4 | 6,8±2,5b | 9,6±3,7b | 6,1±1,4b |
Abreviaturas como no texto. ap<0,01; bp<0,05; c(versus. AAD e VP na mesma condição).
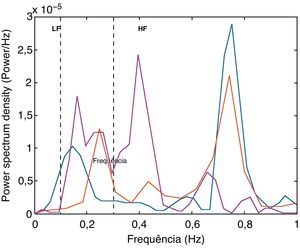
A Figura 4 mostra a análise espectral dos intervalos RR com o padrão de distribuição das bandas de frequências relacionadas com o influxo simpático e parassimpático para o coração. Em comparação com o registo basal, a estimulação vagal aumentou a variabilidade da FC, com uma redução na razão LF/HF, e a estimulação simpática aumentou o componente LF e a razão LF/HF (Figura 5).
Os intervalos de condução entre a AD e a AE aumentaram com a estimulação vagal de 20±4ms para 30±10ms (p<0,05) e diminuíram para 16±6ms com a estimulação simpática (p<0,05). A ativação simpático-vagal simultânea também modificou significativamente a condução interauricular (de 21±5ms to 31±11ms, p<0,05). O tempo de condução entre a AD e as VP aumentou durante a estimulação vagal (p<0,05), diminuiu com a estimulação simpática (p<0,01), mas não teve variação significativa com a estimulação simpático-vagal combinada (Tabela 1).
Relativamente aos valores dos PRE obtidos em basal e durante estimulação autonómica (Tabela 1): em basal, a refratariedade era superior no AAE (83±16ms versus 69±16ms no AAD e 59±16ms nas VP, p<0,01). A estimulação vagal e simpático-vagal causou uma redução significativa consistente dos PRE no AAD, AAE e VP, enquanto a estimulação simpática resultou numa redução dos PRE somente no AAE. Durante a ativação autonómica os PRE diminuíram de forma mais marcada no AAE que nos outros locais. No entanto, com a estimulação vagal mantiveram-se as diferenças estatisticamente significativas entre os PRE das VP e do AAE (p<0,05).
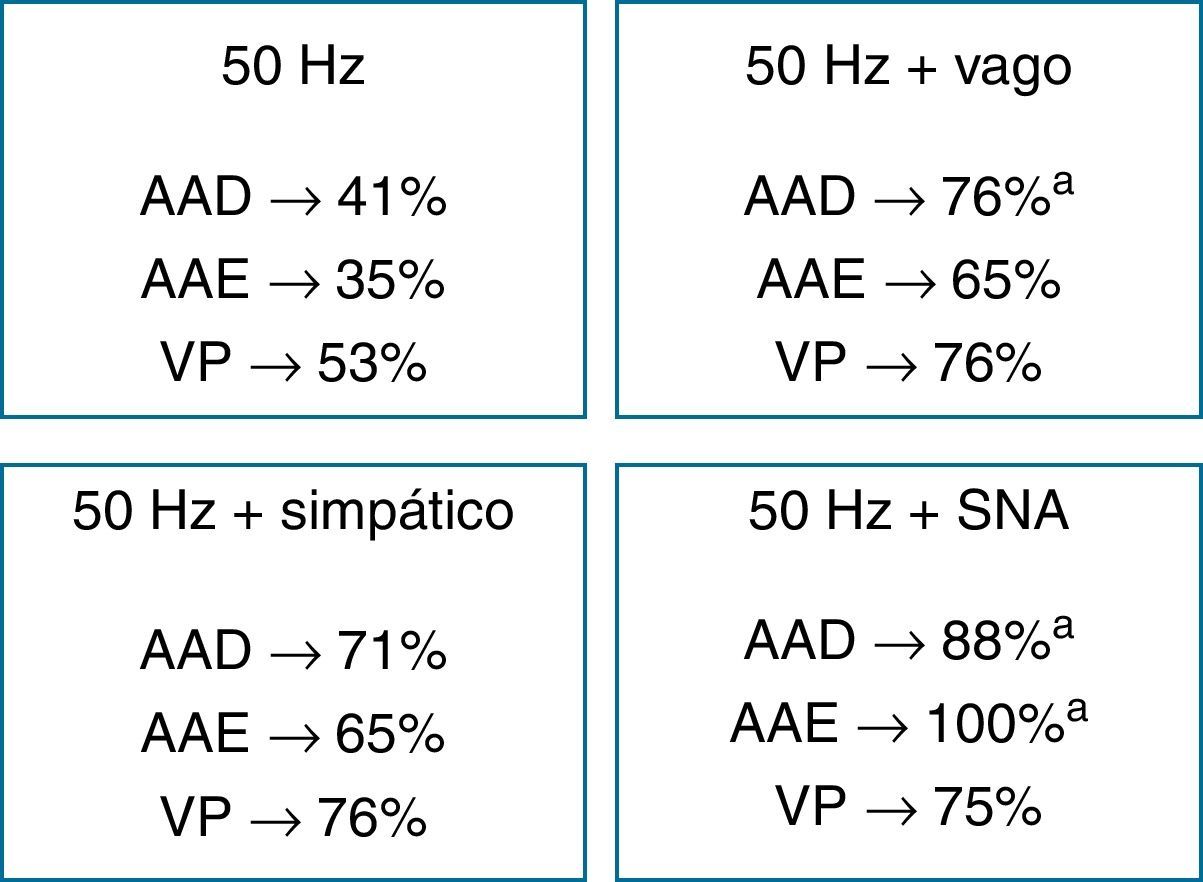
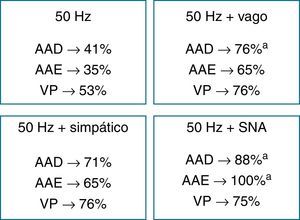
Efeito da estimulação autonómica aguda na inducibilidade de fibrilhação auricularA estimulação autonómica influenciou significativamente a indução e a duração da FA (Tabela 1). Com bursts de 50Hz no AAD, AAE e VP induziu-se FA, de forma intermitente, em 41, 35 e 53% dos coelhos, respetivamente. Durante a estimulação vagal, induziu-se FA, de modo reprodutível, em 76, 65 e 76% dos coelhos com pacing de alta-frequência no AAD, AAE e VP, respetivamente (50Hz versus. 50Hz+vago, p<0,05 para o AAD), e a duração de FA aumentou significativamente com pacing no AAD (6,8±2,5s versus 1,8±1,2s, p<0,01) e VP (3.6±1,6s versus 1,7±0,7s, p<0,05). Em 4 animais, a FA foi iniciada com um extraestímulo combinado com estimulação vagal durante a avaliação do PRE no AAD.
A inducibilidade de FA aumentou durante a estimulação simpática (71, 65 e 76%, para o AAD, AAE e VP, respetivamente), sem atingir significado estatístico. Em dois animais induziram-se curtos períodos de FA com um extraestímulo nos diferentes locais de estimulação, e noutros dois ocorreram despolarizações prematuras espontâneas com origem nas VP. A duração da FA aumentou significativamente somente com estimulação nas VP (9,6±3,7s versus 1,7±0,7s, p<0,05). Durante estimulação combinada simpático-vagal, a FA tornou-se induzível de modo reprodutível com pacing de alta-frequência no AAD, AAE e VP em 88, 100 e 75% dos animais, respetivamente (50Hz versus. 50Hz+simpático e vago, p<0,05 para o AAD e AAE), e a duração da FA aumentou em todos os locais de estimulação. A FA teve duração >10s em 37,5% dos coelhos (somente com estimulação vagal ou simpático-vagal), interrompendo-se imediatamente após suspensão da estimulação vagal em 2/3 dos casos.
DiscussãoO presente estudo analisa o impacto da estimulação autonómica aguda em propriedades eletrofisiológicas auriculares e das VP, e na vulnerabilidade para indução de FA no modelo de coração de coelho in vivo. Através duma metodologia consistente, caracterizámos a influência da estimulação direta do nervo vago cervical direito e tronco simpático torácico na condução elétrica e parâmetros da refratariedade auricular e das VP e mostrámos que a atividade do SNA pode contribuir para a indução e duração de episódios de FA.
Os resultados apontam para um prolongamento do tempo de condução entre as aurículas e as VP em ritmo sinusal, possivelmente relacionado com um atraso na junção AE-VP, que parece associar-se a condução decremental25. Neste modelo experimental, ocorreu um atraso significativo da condução interauricular durante estimulação vagal, e um encurtamento dos tempos de condução durante a ativação simpática. De facto, o tempo médio da condução interauricular foi cerca de duas vezes superior durante estimulação vagal, sendo menor o efeito ao nível da condução AD-VP, sugerindo um padrão não uniforme na resposta à ativação vagal, com impacto diferente nos atrasos de condução elétrica, o que pode relacionar-se com a heterogeneidade da influência da inervação vagal nas propriedades de condução a nível auricular26. Os PRE no AAE foram significativamente superiores aos registados no AAD e VP, sugerindo um perfil heterogéneo da refratariedade nos locais avaliados, quer em condições basais quer durante estimulação vagal. A estimulação vagal diminuiu a refratariedade auricular e das VP, enquanto a ativação simpática obteve uma redução significativa dos PRE somente no AAE. Os efeitos heterogéneos da modulação autonómica na condução e refratariedade das aurículas e VP estão de acordo com possíveis diferenças regionais na inervação cardíaca, que podem influenciar o substrato funcional da FA, que se sabe depender de modificações da condução e do encurtamento dos PRE, de modo a facilitar a ocorrência de múltiplos circuitos de reentrada no tecido auricular25,27. Os PRE mais curtos nas VP e AAD podem justificar a maior inducibilidade de FA com pacing de alta-frequência nestes locais. O aumento consistente da taxa de indução de FA e da duração da arritmia durante a estimulação autonómica aguda sugere que as variações rápidas da condução e refrctariedade locais, e do tónus do SNA possam ser determinantes na vulnerabilidade para FA.
Modelos animais e estudo da vulnerabilidade para fibrilhação auricularNos últimos anos, a experimentação envolvendo modelos animais tem procurado obter informação relativa aos mecanismos básicos subjacentes à fisiopatologia da FA, resultando num importante contributo para a compreensão de hipóteses eletrofisiológicas como a presença simultânea de múltiplas ondas de despolarização com orientação espacial variável, a atividade focal rápida, os rotores com condução fibrilhatória ou mesmo na identificação de zonas de atividade auricular elétrica fragmentada. No entanto, o desenvolvimento de modelos in vivo com inervação autonómica preservada, que permitam uma avaliação eletrofisiológica dinâmica na presença de diferentes condições da atividade do SNA e sua relação com a génese e manutenção da FA permanece um desafio na investigação atual.
Em cães, os circuitos de micro-reentrada, o automatismo e a atividade trigger têm sido apontados como mecanismos associados a ocorrência de arritmias auriculares28,29. Hayashi e colaboradores usaram estimulação vagal cervical para indução de FA com bursts de pacing auricular em cães anestesiados30. Em trabalhos recentes a estimulação vagal tem sido associada a encurtamento dos PRE auriculares e facilitação da indução de FA em cães17,31. Sabe-se que estes efeitos vagais e a inducibilidade de FA podem ser modificados após ablação epicárdica de plexos ganglionares12,15. Também em doentes submetidos a ablação de FA por cateter, o número de recorrências de FA é diminuído quando o procedimento inclui desinervação vagal seletiva32,33. Neste contexto, o conceito de que a desinervação cardíaca possa desempenhar um papel na prevenção da FA representa uma temática complexa e motivadora que necessita ser clarificada.
Em estudos prévios, a estimulação simpática foi menos eficaz do que a estimulação vagal na influência da refratariedade auricular e indução de FA11,34. No entanto, no modelo do cão submetido a pacing rápido crónico, a estimulação simpática induziu atividade repetitiva das VP e contribuiu para iniciar FA35. Também a estimulação combinada do simpático e parassimpático pode influenciar as propriedades eletrofisiológicas e aumentar a propensão para FA em cães16,35. Os efeitos eletrofisiológicos da atividade autonómica reflexa nas aurículas e VP podem assim ter um papel importante na fisiopatologia da FA.
Permanece por esclarecer qual a sequência de mecanismos responsáveis pela interrupção espontânea da FA. Poderia sugerir-se que a resolução (ou «inversão») das alterações autonómicas que acompanham o início da FA contribuem para terminar a arritmia. Tomita et al., demonstraram que as flutuações da atividade do SNA que precedem o início de episódios de FA retornam a valores normais imediatamente após terminar a FA8. No presente trabalho, utilizando o modelo intacto do coração do coelho, que tem baixa propensão para FA em condições basais, confirmámos a importância dos efeitos potenciais da interação simpático-vagal nas alterações da condução e refratariedade das aurículas e VP e sua contribuição para a inducibilidade e duração da FA. Além disso, a atividade vagal pareceu influenciar diretamente a interrupção da FA, já que em 2/3 dos animais com FA de maior duração a arritmia terminou imediatamente após cessação da estimulação vagal.
A evidência do papel do SNA na génese da FA paroxística tem sido suportada em trabalhos clínicos e em modelos experimentais. Apesar de resultados controversos na análise da variabilidade da frequência cardíaca no período que precede o início espontâneo de FA, os episódios paroxísticos recorrentes parecem estar relacionados com flutuações dinâmicas do tónus autonómico, possivelmente dependendo do sinergismo entre o influxo adrenérgico e a modulação da atividade vagal5,18,36,37. São necessários estudos futuros para elucidar o impacto da inervação e da interação da atividade reflexa simpático-vagal na dinâmica complexa do substrato funcional da arritmogénese auricular.
Limitações do estudoUma das limitações diz respeito à avaliação da refratariedade baseada em três locais (AAD, AAE e VP). Na realidade, o procedimento minucioso e demorado de cálculo dos PRE em condições basais e em diferentes condições de estimulação autonómica tornar-se-ia impraticável, nomeadamente no que respeita à manutenção da estabilidade da preparação in vivo. Além disso, a técnica de estimulação elétrica programada com um extraestimulo tem sido amplamente utilizada para o estudo da refratariedade. Estudos futuros poderão justificar o recurso a métodos diferentes para confirmar os atuais resultados. No entanto, no presente trabalho as alterações eletrofisiológicas documentadas, bem como o impacto na indução de FA, ocorreram imediatamente após estimulação autonómica, sugerindo uma clara relação entre os efeitos evocados pela modulação vagal e simpática e os resultados obtidos.
Finalmente, apesar de a indução de FA refletir vulnerabilidade para a arritmia, a dificuldade na sua manutenção, devido à pequena superfície auricular do coração do coelho, torna difícil o estudo dos mecanismos eletrofisiológicos subjacentes à perpetuação da FA.
ConclusõesEste modelo experimental in vivo com inervação preservada permite estudar os efeitos da ativação simpática e vagal nas propriedades eletrofisiológicas das aurículas e VP. Os resultados mostram que a atividade vagal se associa ao aumento da condução interauricular e diminuição dos PRE das aurículas e VP, enquanto a estimulação simpática aumenta a velocidade de condução interauricular e entre as aurículas e VP, mas reduzindo a refratariedade somente no AAE. Esta preparação permite também avaliar o impacto da estimulação autonómica na inducibilidade de FA e sua contribuição para a duração da arritmia. Os nossos dados suportam que o desenvolvimento deste modelo experimental pode fornecer informação importante no estudo da influência das interações da atividade autonómica com os mecanismos fisiopatológicos da FA.
Responsabilidades éticasProteção dos seres humanos e animais. Os autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Conflito de interessesOs autores declaram não haver conflito de interesses.