A endocardite infeciosa (EI) tem uma mortalidade intra‐hospitalar significativa (15‐30%), apesar dos avanços no tratamento médico e cirúrgico.
ObjetivosCaracterização clínica de doentes submetidos a cirurgia cardíaca por EI e identificação de fatores preditores de mortalidade intra‐hospitalar.
Material e MétodosAnálise retrospetiva de 145 doentes com EI admitidos entre janeiro de 2006 a outubro de 2017.
ResultadosA mediana das idades foi de 72 anos. A EI foi maioritariamente adquirida na comunidade (69%), atingiu a válvula aórtica nativa em 54% dos casos, em 22,1% as próteses biológicas e em 10,3% as mecânicas. Os Staphylococcus spp (31%) foram causa mais frequente. A cirurgia cardíaca foi emergente em 29 casos, urgente em 108 e eletiva em 8. As principais indicações foram insuficiência cardíaca (57,9%), vegetações de grandes dimensões (20%), embolização sistémica (17,2%) e disfunção protésica (15,2%). Foram implantadas próteses biológicas em 62,1% dos doentes e próteses mecânicas em 37,2%. Faleceram 19 doentes (13,1%) e os preditores de mortalidade foram, no período pré‐operatório, a fibrilhação auricular e a fração de ejeção do ventrículo esquerdo e, no pós‐operatório, a regurgitação valvular grave associada a choque cardiogénico, a sepsis, o choque séptico associado ao choque cardiogénico, o tamponamento cardíaco, a necessidade de realização de terapêutica de substituição renal e, ainda que tendencialmente, a cirurgia de caráter emergente.
ConclusõesA identificação precoce de melhores indicadores de candidatos a cirurgia, implementação de um Heart Team e uma melhor estratégia cirúrgica (maior precocidade, cuidados pós‐operatórios mais específicos, antibioticoterapia otimizada) são uma necessidade real na EI.
Infective endocarditis (IE) is a serious disease with significant in‐hospital mortality (15‐30%) despite advances in medical and surgical therapy.
AimsTo perform a clinical characterization of patients undergoing cardiac surgery for IE and to identify factors that predict in‐hospital mortality.
MethodsWe retrospectively analyzed 145 patients with IE admitted between January 2006 and October 2017.
ResultsThe median age was 72 years. IE was acquired mainly in the community (69%), and involved the native aortic valve in 54% of patients, biological prosthetic valves in 22.1% and mechanical valves in 10.3%. Staphylococcus spp. (31.0%) were the most frequent etiological agents. Cardiac surgery was emergent in 29 patients, urgent in 108, and elective in eight. The main indications were heart failure (57.9%), large vegetations (20%), systemic embolism (17.2%) and valve dysfunction (15.2%). Overall, biological valves were implanted in 62.1% of patients and mechanical valves in 37.2%. A total of 19 patients (13.1%) died. Predictors of mortality were preoperative atrial fibrillation and lower left ventricular ejection fraction, postoperative severe valve regurgitation associated with cardiogenic shock, sepsis, septic shock associated with cardiogenic shock, cardiac tamponade, need for renal replacement therapy and, although without statistical significance, emergent surgery.
ConclusionsThere is a need for better indicators to enable early identification of surgical candidates for IE, implementation of a heart team, and better surgical strategies, including more rapid intervention, more specific postoperative care, and optimal antibiotic therapy.
Nos doentes com endocardite infeciosa (EI), são indicações comuns para a realização de cirurgia cardíaca a insuficiência cardíaca refratária, a disseminação de infeção com extensão perianular, a presença de micro‐organismos multirresistentes, eventos embólicos recorrentes e a presença de material protésico1. Os objetivos da cirurgia cardíaca são vários e incluem a remoção do tecido infetado, restaurar a integridade cardíaca e a função valvular e remover a potencial fonte de embolias2.
Independentemente da abordagem cirúrgica (das várias técnicas e/ou procedimentos usados – por exemplo, reparação da válvula mitral, implantação de enxerto homográfico aórtico), os resultados a longo prazo são inferiores aos obtidos com a cirurgia eletiva: a sobrevida aos 10 anos varia entre 40 e 60%3.
O presente estudo teve como objetivos: a caracterização sociodemográfica e clínica de uma população de doentes submetidos a cirurgia cardíaca por endocardite infeciosa (EI), incluindo tipo de válvula e agentes microbiológicos envolvidos, tipo de cirurgia e suas indicações e complicações e mortalidade; identificar os fatores que possam predizer a mortalidade intra‐hospitalar.
Material e métodosTipo de estudo e população de doentesNeste estudo retrospetivo, unicêntrico, foram incluídos 145 doentes submetidos a cirurgia cardíaca no contexto de endocardite infeciosa, internados entre janeiro de 2006 e outubro de 2017 (o estudo incluiu doentes admitidos e diagnosticados inicialmente no hospital de referência para realização de cirurgia cardíaca, bem como provenientes de outros hospitais de Portugal).
O diagnóstico de EI definitiva foi considerado de acordo com os critérios de Duke modificados4.
Para cada doente foram colhidos do processo clínico eletrónico e/ou em papel, de forma anónima, dados sociodemográficos, comorbilidades pré‐existentes, status valvular inicial, modo de aquisição da endocardite, dados microbiológicos, ecocardiográficos (transtorácico e transesofágicos; avaliados entre outros aspetos: regurgitação valvular, comprimento e localização da vegetação, função ventricular, presença de abcessos ou fístulas) obtidos nos períodos pré e pós‐operatório e dados relacionados com o envolvimento extracardíaco. O tratamento antimicrobiano, a ocorrência de complicações pré e pós‐operatórias (exemplos: insuficiência cardíaca, extensão perivalvular e embolia cerebral e periférica; extensão perivalvular definida pela presença de abscessos, pseudoaneurismas ou fístulas), indicações de cirurgia e mortalidade foram também registrados. A terapêutica antimicrobiana foi considerada adequada se incluísse antibióticos propostos pelas recomendações vigentes.
A mortalidade intra‐hospitalar foi definida como todas as mortes hospitalares, incluindo a dos doentes transferidos para outras unidades de prestação de cuidados agudos. As indicações para a cirurgia (insuficiência cardíaca, prevenção de eventos embólicos e infeção não controlada), o momento para a cirurgia (emergente – realizada dentro de 24h; urgente – realizada dentro de alguns dias; eletiva – realizada após pelo menos uma a duas semanas de antibioticoterapia)5 e as complicações pós‐operatórias, foram classificadas de acordo com as atuais recomendações da Sociedade Europeia de Cardiologia5.
Análise estatísticaAs variáveis contínuas são resumidas como média ± DP ou como medianas (âmbito interquartil) e intervalo conforme apropriado e foram comparadas usando o teste t de Student. As variáveis categóricas foram comparadas usando o teste do qui‐quadrado ou o exato de Fisher. O nível de significância para todos os testes foi de < 0,05.
ResultadosCaraterísticas basais e antecedentesAs caraterísticas basais, os fatores de risco cardiovascular, antecedentes de patologia cardiovascular e outros antecedentes/comorbilidades dos doentes submetidos a cirurgia cardíaca por endocardite infeciosa (total, sobreviventes versus não sobreviventes) durante o internamento hospitalar podem ver‐se na Tabela 1.
Dados epidemiológicos, fatores de risco cardiovascular, insuficiência cardíaca (FEVE), estádio da doença renal e outras comorbilidades, em todos os doentes com EI submetidos a cirurgia cardíaca (n = 145) e nos doentes que sobreviveram (n = 126) e que não sobreviveram (n = 19) apesar do procedimento cirúrgico
| Total(n = 145) | Sobreviventes(n = 126) | Não sobreviventes(n = 19) | p(Sobreviventes versus não sobreviventes) | |
|---|---|---|---|---|
| Caraterísticas basais | ||||
| Sexo – n (%) | 0,129 | |||
| Masculino | 105 (72,4) | 94 (74,6) | 11 (57,9) | |
| Feminino | 40 (27,6) | 32 (25,4) | 8 (42,1) | |
| Idade (anos) – mediana (âmbito interquartil) | 72 (7) | 69 (14) | 72 (12) | 0,107 |
| Tempo de internamento (dias) – mediana (âmbito interquartil) | 25 (31) | 16 (31) | 25 (22) | 0,457 |
| Fatores de risco cardiovascular | ||||
| Tabagismo – n (%) | 0,638 | |||
| Não fumador | 97 (66,9) | 82 (65,1) | 15 (78,9) | |
| Fumador | 33 (22,8) | 30 (23,8) | ||
| Ex‐fumador | 15 (10,3) | 14 (11,1) | 1 (5,3) | |
| Hipertensão arterial – n (%) | 121 (83,4) | 104 (82,5) | 17 (89,5) | 0,740 |
| Diabetes mellitus – n (%) | 48 (33,1) | 40 (31,7) | 8 (42,1) | 0,371 |
| Dislipidemia – n (%) | 97 (66,9) | 82 (65,1) | 15 (78,9) | 0,231 |
| Obesidade – n (%) | 24 (16,6) | 20 (15,9) | 4 (21,1) | 0,522 |
| Antecedentes cardiovasculares | ||||
| Enfarte agudo do miocárdio – n (%) | 16 (11,0) | 12 (9,5) | 4 (21,1) | 0,228 |
| AVC – n (%) | 8 (5,5) | 8 (6,3) | 0 (0) | 0,597 |
| Insuficiência cardíaca n (%) | 50 (34,4) | 42 (33,3) | 8 (42,1) | 0,453 |
| NYHA classe I | 18 (12,4) | 17 (13,5) | 1 (5,3) | 0,468 |
| NYHA classe II | 24 (16,6) | 19 (15,1) | 5 (26,3) | 0,316 |
| NYHA classe III | 7 (4.8) | 5 (4,0) | 2 (10,5) | 0,229 |
| Fração de ejeção (%) – mediana (âmbito interquartil) | 54 (12) | 56 (11) | 48 (17) | 0,027 |
| Endocardite prévia – n (%) | 5 (3,4) | 4 (3.2) | 1 (5,3) | 0,510 |
| Arritmias cardíacas – n (%) | 29 (20,0) | |||
| Fibrilhação auricular – n (%) | 20 (13,8) | 14 (11,1) | 6 (31,6) | 0,027 |
| Bloqueio auriculoventricular completo – n (%) | 6 (4,1) | 6 (4,8) | 0 (0) | |
| Flutter auricular – n (%) | 3 (2,1) | 3 (2,4) | 0 (0) | |
| ICP prévia – n (%) | 16 (11,0) | 12 (9,5) | 4 (21,1) | 0,228 |
| CABG prévio – n (%) | 3 (2,1) | 2 (1,6) | 1 (5,3) | 0,346 |
| Dispositivos – n (%) | 6 (4,1) | 6 (4,8) | 0 (0) | |
| Outros antecedentes | ||||
| Estadio de doença renal crónica – n (%) | ||||
| I | 23 (15,9) | 20 (15,9) | 3 (15,8) | 1,000 |
| II | 102 (70,3) | 90 (71,4) | 12 (63,2) | 0,462 |
| III | 16 (11,0) | 13 (10,3) | 3 (15,8) | 0,442 |
| V | 4 (2,8) | 3 (2,4) | 1 (5,3) | 0,433 |
| Consumo de drogas ilícitas – n (%) | 1 (0.7) | 1 (0,8) | 0 (0) | 1,000 |
| Infeção por vírus da hepatite C – n (%) | 23 (15,9) | 17 (13,5) | 6 (31,6) | 0,083 |
AVC: acidente vascular cerebral; CABG: cirurgia de revascularização miocárdica; FEVE: fração de ejeção do ventrículo esquerdo; ICP: intervenção coronária percutânea; NYHA: New York Heart Association.
A mediana das idades dos 145 doentes foi de 72 anos e não houve diferenças significativas relativamente à idade no grupo de doentes que sobreviveram (n = 126) durante o internamento (mediana 69) comparativamente com o grupo de doentes que não sobreviveram (n = 19; mediana: 72) (Tabela 1). Globalmente, 27,6% eram do sexo feminino e não se verificaram diferenças significativas quanto à mortalidade relacionada com o género (p = 0,129).
O tempo mediano de internamento foi de 25 dias e não houve diferenças significativas entre as populações de sobreviventes versus falecidos (medianas 16 versus 25; âmbito interquartil, 31 versus 22; p = 0,46).
Antes da cirurgia e na fase de admissão hospitalar, 34,4% dos doentes apresentavam insuficiência cardíaca (IC). Não houve diferenças nem na proporção de doentes com IC (33,3% versus 42,1%; p = 0,45) nem nas diferentes classes funcionais NHYA apresentadas pelos doentes, entre os que sobreviveram ou que vieram a falecer (Tabela 1).
Cinco doentes (3,4%) tinham história de EI prévia. Globalmente, 83,4% dos doentes tinham história de hipertensão arterial, 33,1% diabetes, 66,9% dislipidemia, 33,1% eram fumadores e 16,6% ex‐fumadores; outros antecedentes e comorbilidades podem ver‐se na Tabela 1. Regista‐se ainda que, na fase pré‐operatória, a fibrilhação auricular estava presente em 20 doentes (13,8%), 16 doentes (11%) tinham sido submetidos a intervenção coronária percutânea (ICP) prévia e 3 doentes (2,1%) tinham sido submetidos a cirurgia de revascularização (CABG).
Regista‐se ainda que, na fase pré‐operatória, a fibrilhação auricular estava presente em 20 doentes (13,8%), 16 doentes (11%) foram submetidos a intervenção coronária percutânea (ICP) prévia e 3 doentes (2,1%) a cirurgia de revascularização prévia (CABG). Todos os 145 doentes tinham algum grau de disfunção renal e 70% (n = 102) tinha um clearance da creatinina entre 60 e 90ml/min/1,73 m2 (estádio II). Quando se compara o grupo de sobreviventes com o grupo de não sobreviventes quanto às várias características basais, apenas em dois dos parâmetros analisados se registaram diferenças estatisticamente significativas: a fração de ejeção (FE) do ventrículo esquerdo (VE) era menor nos não sobreviventes (48% versus 56%; p = 0,027) e a fibrilhação auricular era mais prevalente no grupo dos não sobreviventes (31,6% versus 11,1%; p = 0,027).
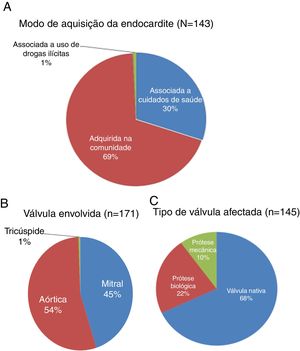
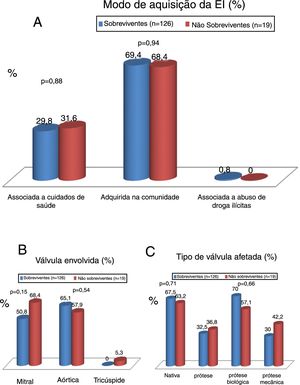
Modo de aquisição, válvula envolvida e tipo de válvula afetadaNa Figura 1 podem ver‐se o modo de aquisição da endocardite infeciosa (EI), a válvula envolvida e o tipo de válvula afetada (nativa versus prótese biológica ou mecânica) e na Figura 2 os resultados relacionados com a comparação entre os doentes que sobreviveram e os que não sobreviveram após o procedimento cirúrgico.
A EI foi adquirida na comunidade em 69% dos casos e associada aos cuidados de saúde em 30% dos casos; não houve diferenças significativas na proporção de doentes que sobreviveram ou faleceram, quanto à EI adquirida na comunidade (69,4% versus 68,4%; p = 0,94), ou relacionada com os cuidados de saúde (29,8% versus 31,6%; p = 0,88) (Figura 2).
A válvula aórtica foi a mais frequentemente afetada (54%), seguida pelo atingimento da válvula mitral (45%). A mortalidade não foi significativamente diferente nos indivíduos com válvulas diferentes afectadas pela EI (Figura 2).
Em 25 doentes, ambas as válvulas, aórtica e mitral, foram afetadas. As válvulas nativas foram as mais frequentemente afetadas (69,7%), seguindo‐se o envolvimento das próteses biológicas (22%) e das próteses mecânicas (10,3%). A mortalidade também não diferiu quanto ao tipo de válvula envolvida (nativa ou prótese biológica ou mecânica) (Figura 2).
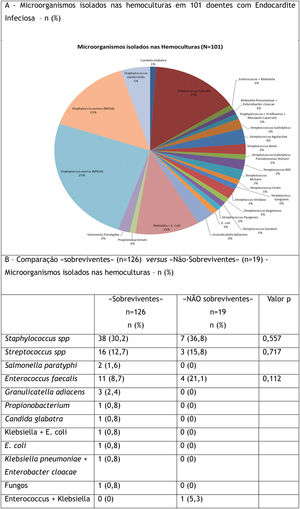
Como se pode ver na Figura 3A, nos 101 doentes em que foi possível isolar nas hemoculturas o micro‐organismo, predominou o Staphylococcus aureus meticilino‐resistente (MRSA) (25%) como agente etiológico da EI. Foram ainda isoladas: Staphylococcus aureus meticilino sensível (MSSA) (15%), bactérias do género estreptococos (15%), Enterococcus faecalis (15%) e Staphylococcus epidermidis (5%), entre outros (Figura 3).
A etiologia microbiana da EI não foi significativamente diferente no grupo dos doentes que sobreviveram versus os que faleceram.
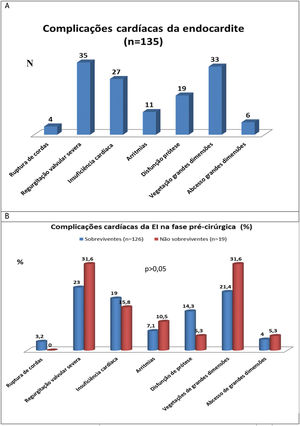
Complicações cardíacas e extracardíacasNa Figura 4, podem ver‐se os resultados referentes a complicações cardíacas e extracardíacas da EI antes do procedimento cirúrgico (A) e comparação das mesmas complicações nos grupos de sobreviventes e não sobreviventes (B).
As complicações cardíacas mais frequentemente encontradas nos doentes antes de serem submetidos a cirurgia cardíaca (n = 135) foram a regurgitação valvular severa (24,1%), a presença de vegetações com dimensão superior a 10mm (22,8%) e as manifestações de insuficiência cardíaca (18,6%). A proporção destas complicações não foi significativamente diferente nos doentes que sobreviveram versus os que faleceram. (Figura 4B). As complicações extracardíacas mais frequentemente encontradas nos doentes com EI, antes do procedimento cirúrgico, foram a embolização sistémica (17,2%), a lesão renal aguda (definida como aumento da creatinina plasmática ≥ 0,3mg/dl dentro de 48 horas ou ≥ 50% acima do valor basal conhecido ou presumido que tenha ocorrido nos 7 dias anteriores)6 ou agravada (14,5%), a sepsis (10,3%) e insuficiência respiratória (9%) (Tabela 2). Estas complicações extracardíacas não foram significativamente diferentes quando se comparam os doentes que sobreviveram com os que faleceram (Tabela 3).
Dados globais das complicações extracardíacas na fase pré‐cirúrgica n (%)
| Embolização sistémica | 25 (17,2) |
|---|---|
| Insuficiência respiratória | 13 (9,0) |
| Sepsis | 15 (10,3) |
| Lesão renal aguda | 21 (14,5) |
| Hemorragia digestive | 1 (0,7) |
| Crise convulsive | 1 (0,7) |
| Disfunção hepática e agravamento da função renal | 1 (0,7) |
Comparação das complicações extracardíacas na fase pré‐cirúrgica entre sobreviventes e não sobreviventes n (%)
| Sobreviventes(n = 126) | Nao sobreviventes(n = 19) | p | |
|---|---|---|---|
| Embolização sistémica | 22 (17,5) | 3 (15,8) | 1,00 |
| Insuficiência respiratória | 12 (9,5) | 1 (5,3) | |
| Sepsis | 7 (5,6) | 8 (42,1) | <0,001 |
| Lesão renal aguda | 17 (13,5) | 4 (21,1) | 0,48 |
| Hemorragia digestiva | 1 (0,8) | 0 | |
| Crise convulsiva | 1 (0,8) | 0 | |
| Disfunção hepática e agravamento da função renal | 1 (0,8) | 0 |
A embolização sistémica, a complicação extracardíaca mais frequente, manifestou‐se como AVC isquémico em 12 casos, AVC hemorrágico em 2, enfarte esplénico em 6, enfarte renal em 3, embolização para o membro superior esquerdo num caso e embolização para o membro inferior direito noutro.
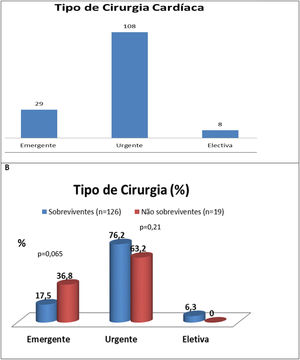
Tipo de cirurgia cardíacaNa Figura 5 A pode ver‐se que a cirurgia realizada dentro de alguns dias (urgente)5 foi o «recurso» mais vezes utilizado (74,5%) seguida da emergente (realizada nas primeiras 24h)5 (20%) e da eletiva (5,6%). Como se pode ver na Figura 5B, só nos doentes que foram operados de emergência é que a proporção dos que faleceram foi tendencialmente maior (36,8% versus 17,5%, p = 0,065) ao contrário do verificado para os doentes operados com carácter urgente (63,2% versus 76,2%, p = 0,21) ou eletivamente (nenhuma morte).
A ‐ Tipo de cirurgia (emergente, urgente, electiva) realizada; B ‐ Subanálise nos grupos de sobreviventes versus não sobreviventes (B).
Cirurgia de emergência: cirurgia realizada dentro de 24 h5; cirurgia urgente: realizada dentro de alguns dias (< 7 dias)5; cirurgia eletiva: após pelo menos uma a duas semanas de antibioticoterapia14.
A causa mais frequente de realização de cirurgia cardíaca (Tabela 4) foi a insuficiência cardíaca refratária (57,9%) (regurgitação valvular grave, choque cardiogénico, disfunção de prótese), seguida da infeção não controlada (31%) (vegetações e abcessos de grandes dimensões) e para prevenir fenómenos cardioembólicos em 11% dos casos. Os doentes com insuficiência cardíaca em choque cardiogénico causada por regurgitação valvular grave tiveram uma mortalidade significativamente maior (35,7% versus 5,7%; p = 0,005).
Motivo principal de cirurgia números globais e relativos aos sobreviventes e não sobreviventes
| Motivo principal de cirurgia | ||||
|---|---|---|---|---|
| Totaln = 145 | Sobreviventes n = 126 | Não sobreviventes n = 19 | Valor p(Sobreviventes’ versus não sobreviventes) p | |
| Insuficiência cardíaca – n (%) | 84 (57,9) | 71 (56,3) | 13 (68,4) | 0,320 |
| Regurgitação valvular grave + choque cardiogénico | 9 (6,2) | 4 (5,7) | 5 (35.7) | 0,005 |
| Disfunção de prótese e insuficiência cardíaca persistente | 22 (15,2) | 20 (28,6) | 2 (14,3) | 0,337 |
| Regurgitação valvular grave e insuficiência cardíaca persistente | 50 (34,5) | 44 (62,9) | 6 (42,9) | 0,164 |
| Regurgitação valvular grave + EAP refractário | 3 (2,1) | 2 (2,9) | 1 (7,1) | |
| Infeção não controlada – n (%) | 45 (31,0) | 39 (31,0) | 6 (31,6) | 0,956 |
| Vegetações de grandes dimensões (>10 mm) | 23 (15,9) | 21 (52,5) | 2 (40,0) | 0,665 |
| Abcesso de grandes dimensões | 14 (9,7) | 11 (27,5) | 3 (60,0) | 0,166 |
| Vegetações de grandes dimensões com rutura de cordas | 6 (4,1) | 6 (15,0) | 0 (0) | |
| Pseudo‐aneurisma + fístula | 2 (1,4) | 2 (5,0) | 0 (0) | |
| Prevenção de embolismo – n (%) | 16 (11,0) | 16 (12,7) | 0 (0) | |
Globalmente, foram implantadas 90 próteses biológicas (75 nos sobreviventes e 15 nos que vieram a falecer) e 54 próteses mecânicas (49 nos sobreviventes e 5 nos que vieram a falecer) e foi efetuada uma valvuloplastia mitral com exérese de vegetação (Tabela 5). Predominaram as substituições das válvulas nativas por próteses biológicas (n = 18 em posição mitral e n = 21 em posição aórtica). Foram implantadas próteses mecânicas em posição mitral em 9 doentes e em posição aórtica em 18 doentes.
Tipo de procedimento cirúrgico
| Tipo de procedimento | Sobreviventes (n = 126) | Não Sobreviventes(n = 19) |
|---|---|---|
| Na válvula mitral nativa ou na prótese em posição mitral – n | ||
| Substituição da válvula mitral nativa por prótese biológica | 14 | 4 |
| Substituição da válvula mitral nativa por prótese mecânica | 11 | 2 |
| Substituição de prótese biológica em posição mitral por outra prótese biológica | 6 | 1 |
| Substituição de prótese biológica em posição mitral por prótese mecânica | 1 | 0 |
| Substituição de prótese mecânica em posição mitral por prótese biológica | 3 | 1 |
| Substituição de prótese mecânica em posição mitral por outra prótese mecânica | 4 | 0 |
| Valvuloplastia mitral e exérese da vegetação | 2 | 0 |
| Na válvula aórtica nativa ou na prótese em posição aórtica – n | ||
| Substituição da válvula aórtica nativa por prótese biológica | 19 | 2 |
| Substituição da válvula aórtica nativa por prótese mecânica | 18 | 0 |
| Substituição de prótese biológica em posição aórtica por outra prótese biológica | 17 | 2 |
| Em mais do que uma válvula nativa ou mais do que uma prótese e/ou tecidos adjacentes – n | ||
| Substituição das válvulas mitral e aórtica nativas por próteses biológicas | 8 | 3 |
| Substituição das válvulas mitral e aórtica nativas por próteses mecânicas | 9 | 1 |
| Substituição da válvula mitral nativa por prótese biológica + substituição de prótese aórtica biológica por outra prótese biológica | 3 | 0 |
| Substituição da válvula mitral nativa por prótese mecânica+ anuloplastia tricúspide | 2 | 0 |
| Substituição de prótese biológica em posição mitral e de prótese biológica em posição aórtica por outras próteses biológicas | 2 | 1 |
| Substituição de prótese mecânica em posição aórtica por outra prótese mecânica + limpeza/encerramento da loca de abcesso mitro‐aórtico | 3 | 2 |
| Substituição de prótese mecânica em posição aórtica por prótese biológica + substituição da válvula mitral nativa por prótese biológica | 1 | 0 |
| Substituição da válvula aórtica nativa por prótese mecânica + plastia mitral + plastia tricúspide | 1 | 0 |
| Substituição de prótese biológica em posição aórtica por outra prótese biológica + substituição da válvula mitral nativa por prótese biológica + anuloplastia tricúspide | 2 | 0 |
As complicações pós‐cirúrgicas mais frequentemente observadas (Tabela 6) foram a uremia com a necessidade de realizar hemodiálise (24,8%) (presença de sinais e sintomas ainda que inespecíficos e não estando todos presentes simultaneamente, como, por exemplo, náuseas, vómitos, encefalopatia, convulsões, hemorragias, hipervolemia, dor pleurítica, pericardite, dispneia, hipercaliemia e clearance de creatinina < 8‐10mL/min/1,73 m2 e opinião de especialista de nefrologia para início de hemodiálise)7, a lesão renal aguda6, o bloqueio auriculoventricular do 3.° grau (12,4%), fibrilhação auricular (8,3%) e sepsis (6,9%). De todas as complicações analisadas, três delas foram significativamente mais frequentes nos doentes que vieram a falecer do que nos que sobreviveram (Tabela 6B): sepsis (36,8% versus 2,4%; p < 0,001), tamponamento cardíaco (15,8% versus 1,6%; 0,016), e a presença de choque cardiogénico mais choque séptico (15,8% versus nenhuma morte).
Complicações globais pós‐cirurgia (A) e comparação de algumas dessas complicações entre os doentes do grupo de sobreviventes e grupo de não sobreviventes (B)
| A Complicações globais pós‐cirurgia ‐ n (%) | |
|---|---|
| Fibrilhação auricular | 12 (8,3) |
| Bloqueio auriculoventricular (3.° grau) | 18 (12,4) |
| Sepsis | 10 (6,9) |
| Lesão renal aguda | 24 (16,6) |
| AVC | 3 (2,1) |
| Insuficiência respiratória | 8 (5,6) |
| Infeção respiratória | 7 (4,8) |
| Tamponamento | 5 (3,4) |
| Cistostomia suprapública | 1 (0,7) |
| Derrame pleural de grande volume, com necessidade de toracocentese | 2 (1,4) |
| Choque cardiogénico e choque séptico | 3 (2,1) |
| Eritema tóxico | 2 (1,4) |
| Infeção ginecológica | 1 (0,7) |
| Drenagem abundante com necessidade de reesternotomia | 2 (1,4) |
| Tromboembolismo pulmonary | 1 (0,7) |
| Miopatia de desuso | 2 (1,4) |
| Disfunção hepática + agravamento da função renal | 1 (0,7) |
| Infeção do trato urinário | 2 (1,4) |
| Trombose femoral esquerda submetida a trombectomia | 1 (0,7) |
| Diálise pós‐cirurgia | 36 (24,8) |
| B Comparação de algumas dessas complicações entre os doentes do grupo de sobreviventes e grupo de não sobreviventes ‐ n (%) | |
| Sobreviventes(n = 126) | Não sobreviventes(n = 19) | p | |
|---|---|---|---|
| Fibrilação auricular | 11 (8,7) | 1 (5,3) | |
| Bloqueio auriculoventricular (3.°grau) | 15 (11,9) | 3 (15,8) | 0,707 |
| Sepsis | 3 (2,4) | 7 (36,8) | <0,01 |
| Lesão renal aguda | 23 (18,3) | 1 (5,3) | |
| AVC | 3 (2,4) | 0 (0) | |
| Insuficiência respiratória | 7 (5,6) | 1 (5,3) | |
| Infeção respiratória | 7 (5,6) | 0 (0) | |
| Tamponamento | 2 (1,6) | 3 (15,8) | 0,016 |
| Cistostomia suprapública | 1 (0,8) | 0 (0) | |
| Derrame pleural de grande volume, com necessidade de toracocentese | 2 (1.6) | 0 (0) | |
| Choque cardiogénico e choque séptico | 0 (0) | 3 (15,8) | 0,002 |
A morte intra‐hospitalar ocorreu em 19 doentes operados com EI (13,1%) e o choque séptico (47,4%) e o choque cardiogénico (36,8%) foram as suas principais causas (Tabela 7).
Os doentes que faleceram tinham, na fase pré‐cirúrgica, uma fração de ejeção do ventrículo esquerdo significativamente mais baixa (mediana: 48% versus 56%; p = 0,027), e fibrilhação auricular mais prevalente (31,6% versus 11,1% p = 0,027) (Tabela 1).
A sepsis no período pré e pós‐operatório, a necessidade de efetuar cirurgia de emergência nas primeiras 24h (comparativamente com cirurgia urgente ou eletiva), a presença de regurgitação valvular grave associada a choque cardiogénico prévios ou a presença de tamponamento como complicação pós‐operatória foram também fatores associados a uma mortalidade significativamente maior.
DiscussãoA súmula deste estudo pode integrar dois aspetos globais e distintos, que servem para efetuar uma análise comparativa com os resultados de estudos similares: 1) no presente estudo, a maior percentagem de doentes afetados pela EI foram homens (72,4%), os micro‐organismos mais frequentemente isolados foram o Staphylococcus aureus seguido do Streptococcus spp e a válvula aórtica nativa foi a mais afetada. A cirurgia de caráter urgente (realizada dentro de alguns dias; < 7 dias)5 foi a mais indicada, sendo o principal motivo da sua realização a insuficiência cardíaca refratária, seguida das vegetações de grandes dimensões. A cirurgia teve como complicações mais frequentes, a uremia com necessidade de hemodiálise, a lesão renal aguda e o BAV do 3.° grau. A mortalidade global intra‐hospitalar foi de 13,1% e o choque séptico e cardiogénico foram as principais causas de morte; 2) foram preditores de maior mortalidade intra‐hospitalar: a necessidade de cirurgia de caráter emergente (realizada dentro de 24h)5; uma menor fração de ejeção do ventrículo esquerdo (FEVE) antes do procedimento cirúrgico; a presença de fibrilhação auricular, sepsis/choque séptico nos períodos pré e pós‐operatório; choque cardiogénico, tamponamento e necessidade de terapêutica de substituição renal no período pós‐operatório.
A mortalidade intra‐hospitalar e/ou aos 30 dias associada à cirurgia foi de 13,1% no nosso estudo, semelhante à encontrada no estudo retrospetivo (15%) de Moreira et al. (2018)8 (133 doentes submetidos a cirurgia cardíaca por EI e de Farag et al. (2017)1 (18,3% em 360 doentes operados) e mais elevada do que do estudo de Ferreira et al. (2014)9 (3,7% em 54 doentes operados por EI). Os fatores preditivos de mortalidade intra‐hospitalar descritos por Moreira et al.8 (doença pulmonar obstrutiva crónica, embolia cerebral, EI causada por Staphylococcus spp e não HACEK bacilos de Gram‐negativo) e por Ferreira et al.9 (em todos os doentes com EI submetidos a cirurgia cardíaca ou não: índice de Charlson ≥ 5, EuroSCORE > 6, uso de imunossupressores, sepsis [sepsis severa e/ou choque séptico] e antibioticoterapia inapropriada) e por Farag et al.1 (idade mais avançada, diabetes mellitus pré‐operatória mais prevalente, classe NYHA da IC mais elevada e insuficiência renal e insuficiência hepática, maior duração do tempo da cirurgia, da circulação extracorporal e do tempo de clampagem da aorta, maior volume de transfusão de glóbulos rubros e transfusão de plasma fresco e de plaquetas) foram diferentes dos encontrados neste estudo. Muitas das variáveis enunciadas nos estudos citados1,8,9 não foram avaliadas no presente estudo. A heterogeneidade das características basais dos doentes com EI, incluídos nos diversos estudos, pode explicar os diferentes fatores preditores de mortalidade encontrados, comparativamente com o presente estudo. Por exemplo, no estudo de Moreira et al.8, a diabetes, a insuficiência renal crónica e o etiologia por Staphylococcus spp foram menos frequentes, enquanto que a história de endocardite prévia e a presença de vegetações > 10mm foram mais frequentes; nos estudos de Farag et al.1, Moreira et al.8, Ferreira et al.9, as médias das idades dos doentes incluídos foram inferiores.
Algumas comorbilidades podem ter impacto importante sobre a mortalidade. No presente estudo, apenas 8 doentes tinha AVC prévio (5,5%) e todos sobreviveram e 13,8% tinham insuficiência renal crónica (IRC) (clearance de creatinina <60mL/min/1,73 m2), não se registando diferenças significativas da proporção de doentes que sobreviveram ou não, de acordo com o grau de disfunção renal; mas quando foi necessária a realização de procedimento dialítico no pós‐operatório, a mortalidade foi significativamente maior (78,9% vs. 16,7%; p < 0,001). A proporção de doentes com história recente de AVC e/ou IRC no nosso estudo foi inferior ao observado no estudo de Farag et al. (2017)1. Embora no nosso estudo o número de doentes com AVC prévio fosse pequeno e, portanto, obvie conclusões práticas, Misfeld et al. (2014)10 mostraram que doentes com EI e embolia cerebral têm uma sobrevida aos cinco anos, menor do que os que não tiveram embolia cerebral. Nos doentes que têm alta hospitalar, globalmente, a sobrevida é superior a 60% aos 10 anos. Farag et al.1 estimaram uma sobrevida média de 69,4% no primeiro ano, 63,3% aos 5 anos e 63,3% aos 10 anos pós‐cirurgia cardíaca por EI.
No presente estudo só foram abordados os doentes que foram submetidos a cirurgia cardíaca por EI, mas não foi analisado o grupo de doentes internados no mesmo centro hospitalar, que foi apenas alvo de terapêutica médica. Atualmente, segundo Cahill et al. (2017)2, 50‐60% dos doentes com EI são submetidos a cirurgia cardíaca; Moreira et al.8 mostraram que os doentes com EI que foram submetidos a cirurgia cardíaca tiveram uma taxa de mortalidade intra‐hospitalar significativamente menor, comparativamente com os que não foram operados (15,5% versus 32,6%, p = 0,028), tal como o verificado por Ferreira et al.9. O nosso estudo não contemplou esta metodologia, o que seria muito importante para poder retirar conclusões mais sólidas, sobre vários parâmetros, incluindo o das potenciais indicações cirúrgicas e seu timing mais adequado.
A mortalidade aos 30 dias do pós‐operatório de EI é de 15‐20%1,11–13, semelhante à verificada no presente estudo.
A insuficiência cardíaca (IC) foi o principal motivo da cirurgia na maioria dos doentes incluídos (57,9%), tal como o verificado no estudo de Farag et al.1 (cerca de metade tinham IC classe IV da NYHA); os principais mecanismos envolvidos foram a regurgitação valvular grave e a disfunção de prótese. A infeção não controlada (vegetações e abcessos de grandes dimensões) e a prevenção de fenómenos cardioembólicos foram outros motivos para a realização de cirurgia cardíaca. Estas são as três indicações cirúrgicas com benefício potencial para o doente com EI (devendo ser identificadas precocemente para obter melhores resultados cirúrgicos, diminuindo assim a mortalidade precoce e a longo prazo), preconizadas pela Sociedade Europeia de Cardiologia5 e, por exemplo, por Cahill et al. (2017)2. Todos os doentes deste nosso estudo de coorte foram sujeitos a cirurgia cardíaca, mas não foram analisados dados referentes a doentes com potencial indicação cirúrgica e que não foram operados. Segundo Chu et al. (2015)13, no «mundo real» 24% de doentes com indicação cirúrgica baseada nas recomendações internacionais não são submetidos a cirurgia, sendo as razões evocadas2 o mau prognóstico «antecipado» independentemente do tratamento instituído (34%), a instabilidade hemodinâmica (20%), morte antes da cirurgia (23%), AVC (23%), sepsis (21%) e recusa do cirurgião em operar (26%). A cirurgia realizada com caráter urgente (realizada dentro de alguns dias; < 7 dias)5 foi a mais frequentemente realizada (74,5%). A cirurgia urgente foi realizada em 76,2% dos doentes que sobreviveram e em 63,2% dos que faleceram; p = 0,21) e a cirurgia emergente (realizada dentro de 24h) foi realizada em 17,5% dos doentes que sobreviveram e em 36,8% dos que faleceram; p = 0,065 (Figura 5). Moreira et al.8 concluíram que a realização de cirurgia cardíaca precoce na EI (realizada antes dos primeiros 7 dias – portanto urgente) não esteve associada a uma maior mortalidade quando comparada com a cirurgia mais tardia.
O perfil e a proporção relativa de agentes microbianos encontrados neste estudo foi semelhante ao encontrado no estudo de Farag et al.1 com predomínio das espécies de Staphylococcus (45%) [Staphylococcus aureus meticilino‐resistente (MRSA) 25% + Staphylococcus aureus meticilino sensível (MSSA) 15% + Staphylococcus epidermidis 5%)]; não foi avaliada a histopatologia/microbiologia dos tecidos excisados durante a cirurgia (hoje um gold‐standard do diagnóstico na EI)5,14, nem avaliada/caraterizada a antibioticoterpia no pós‐operatório (aspetos relevantes para melhor apurar o valor de alguns preditores de mortalidade). Tal como afirmam Farag et al.1, o panorama microbiológico tem vindo a mudar, de tal forma que as espécies de Staphylococcus predominam como agentes etiológicos, que, sendo mais «agressivos/invasivos», podem explicar a formação de vegetações e de abcessos de grandes dimensões, motivo por si só para indicação cirúrgica (como se veio a verificar no nosso estudo em 29,7% dos casos). A EI causada por Staphylococcus tem sido repetidamente associada a uma maior mortalidade15,16, o que não se verificou neste estudo.
Muitas outras variáveis podem estar associadas a uma maior mortalidade na cirurgia cardíaca de doentes com EI.
Vários autores17,18 demonstraram uma relação entre a presença de vegetações > 10mm de dimensão, abcessos de grandes dimensões, falsos aneurismas e fístulas11,19,20 e eventos adversos/prognóstico, mas no atual estudo não houve aumento significativo da mortalidade relacionada com aqueles indicadores de infeção não controlada (embora se deva salvaguardar o tamanho pequeno da amostra).
A presença de regurgitação valvular grave e choque cardiogénico no mesmo doente associou‐se a uma maior mortalidade aos 30 dias; de acordo com as guidelines da ESC5, a cirurgia deve ser realizada com caráter de emergência (ou o mais precocemente possível)21, independentemente do estado de infeção, quando os doentes estão em edema agudo do pulmão ou choque cardiogénico apesar da terapêutica médica22,o que aumenta a mortalidade, como o que se verificou neste estudo. A cirurgia deve ser realizada com caráter urgente quando a IC é menos grave e/ou quando há insuficiência aórtica grave ou mitral grave com grandes vegetações, mesmo sem IC23.
Também como noutros estudos1,8, as válvulas nativas foram as mais frequentemente afetadas, seguindo‐se o envolvimento das próteses biológicas e das próteses mecânicas, não se tendo, no entanto, registado diferenças significativas na mortalidade intra‐hospitalar (válvula nativa versus prótese biológica e/ou mecânica) relativa ao tipo de válvula/prótese, ao contrário de uma maior mortalidade relatada por outros autores no contexto de envolvimento de próteses valvulares1,24.
As complicações cardíacas principais antes da cirurgia cardíaca por EI neste estudo são similares no tipo (a maioria das vezes fenómenos que colocam indicação cirúrgica premente e não raras vezes life‐saving), mas diversas na frequência encontrada noutros estudos1,5,8 (regurgitação valvular severa; insuficiência cardíaca refratária – cerca de 15% neste estudo; vegetações de grandes dimensões e disfunção de prótese valvular) podem contribuir para encontrar preditores de mortalidade pós‐operatória na EI diferentes, que já foram discutidos previamente. As complicações extracardíacas (as mais frequentes no nosso estudo: embolização sistémica, insuficiência respiratória, sepsis e disfunção renal), que por si colocam riscos pré‐operatórios tão diversos, também se expressam em proporções diferentes de estudo para estudo1,8, condicionando um conjunto diferente de atitudes anestésicas, de suporte transfusional – e suas consequências nos parâmetros da coagulação –, de terapêutica farmacológica e de suporte mecânico circulatório, de procedimentos cirúrgicos permitidos ou selecionados (tempos de cirurgia, de cardioplegia, de circulação extracorporal e de clampagem aórtica1; tipo de prótese a implantar, homoenxerto, extensão do desbridamento/ressecção de tecidos intracardíacos, incluindo tecido paravalvular/possível envolvimento do tecido de condução e/ou do annulus valvular, uso de patches de Dacron, esquema de hipotermia)1, que no seu todo estão associados com agressividade tão diversa, e por isso mesmo com repercussão tão dissimilar na mortalidade pós‐operatória, tornando muito difícil comparar os preditores relatados nos estudos publicados ao longo das últimas duas décadas. Alguns destes fatores enunciados constituíram os melhores preditores de mortalidade no estudo de Farag et al.1 (tempos de cirurgia, de cardioplegia, de circulação extracorporal e de clampagem aórtica; suporte transfusional massiva – e suas consequências nos parâmetros da coagulação).
As próteses biológicas foram as selecionadas para a maioria dos doentes com EI (62,1%), não tendo ficado expressa no processo clínico a fundamentação desta escolha (como, por exemplo, idade, necessidade de anticoagulação oral, risco hemorrágico, presunção da adesão à terapêutica, entre outros fatores). No estudo de Lee et al. (2018)25, nos doentes com endocardite infeciosa (n = 71) que tiveram necessidade de substituição da válvula mitral, na maioria desses doentes (75,8%) houve substituição da válvula nativa por uma prótese biológica e em 24,3% dos doentes foi implantada uma prótese mecânica.
Neste nosso trabalho, de todas as complicações pós‐operatórias, destaca‐se que a fibrilhação auricular, a sepsis e o tamponamento, foram significativamente mais frequentes nos doentes que vieram a falecer durante o internamento. De acordo com David et al. (2007)26, as complicações pós‐operatórias da EI mais frequentes são a coagulopatia grave, reexploração do tórax por hemorragia ou tamponamento (no nosso estudo associado a um aumento da mortalidade: 15,8% nos doentes que faleceram versus 1,6% nos doentes que sobreviveram; p = 0,016), lesão renal aguda/uremia, que requereu hemodiálise (no estudo atual, a complicação pós‐operatória mais frequente, com 24,8% dos doentes a requererem técnica dialítica com repercussão óbvia num aumento significativo da mortalidade intra‐hospitalar associada: 78,9% versus 16,7%; p < 0,001), insuficiência cardíaca (mais uma vez confirmada no presente estudo, sobretudo a relacionada com regurgitação valvular grave e choque cardiogénico concomitante (35,7% versus 5,7%; p = 0,005), pneumonia, bloqueio AV do 3.° grau (no contexto de ressecção radical da raiz da aorta por abcesso, com necessidade de implantação de pacemaker)26.
A fibrilhação auricular de «novo» no nosso estudo foi menos frequente (8,3%) do que está descrito na literatura relativamente ao pós‐operatório de cirurgia cardíaca (15‐45%)27; a fibrilhação que aparece no período pós‐operatório de cirurgia cardíaca está associada a um tempo de internamento maior e a mais elevadas taxas de complicações e de mortalidade28 (como a verificado no presente estudo).
Este estudo apenas avaliou a mortalidade intra‐hospitalar que foi de 13,1% (choque séptico e o choque cardiogénico foram as principais causas de morte) e que foi ligeiramente menor do que a referida por Farag et al.1 (18,3% aos 30 dias). Kang et al.23 mostraram que doentes com EI submetidos a cirurgia cardíaca precoce tiveram um endpoint composto de morte por qualquer causa, eventos embólicos ou recorrência da EI aos seis meses significativamente menores. Farag et al.1 constataram uma sobrevida no pós‐operatório de EI de 63,3% aos cinco anos, 63,3% aos 10 anos e 48,3% aos 20 anos.
Este e outros trabalhos demonstram que no contexto de EI a cirurgia tem muitas vezes um papel crucial, frequentemente life‐saving14, como são as situações relacionadas com rutura de cordas tendinosas, com regurgitação valvular severa, disfunção de prótese biológica ou mecânica, insuficiência cardíaca refratária, sepsis que não cede a antibioticoterapia, vegetações e abcessos intracardíacos de grandes dimensões e prevenção de fenómenos de cardioembolização.
No presente estudo, vários foram os aspetos não estudados cabalmente, como é o caso do tempo de internamento e as suas caraterísticas. Por exemplo, faltou a abordagem do tempo de internamento entre o diagnóstico inicial e o da intervenção cirúrgica e entre a intervenção cirúrgica e a alta ou a morte intra‐hospitalar e o tempo de duração de outras medidas terapêuticas instituídas nos períodos pré e pós‐operatórios, indicadores potenciais de informações acerca da qualidade do tratamento14, bem como das complicações que possam ter prolongado o internamento e influenciar a mortalidade intra‐hospitalar e a médio e longo prazos14.
No nosso estudo, dado o seu cariz retrospetivo, não foi possível apurar vários elementos, no processo clínico, que são fundamentais para calcular os scores usados para estimar o risco de morte pós‐cirurgia cardíaca nos doentes com EI (como por exemplo, o AEPEI – Association pour l’Etude et la Prevention de l’Endocadite Infectieuse e AEPEI modificado e o PALSUSE) e analisar os preditores da mortalidade intra‐hospitalar (nomeadamente no que concerne aos parâmetros incluídos no Euroscore II, por exemplo os relacionados com o considerado estado crítico, que faz parte integrante do score AEPEI e do score PALSUSE). Assim, não foi exequível validar esta excelente ferramenta de preditores de risco nos doentes com EI incluídos nesta investigação. No futuro, a realização de um estudo prospetivo poderá responder a tantas dúvidas suscitadas pelos resultados da presente investigação.
LimitaçõesEste estudo tem várias limitações. Trata‐se de um estudo retrospetivo (vários dados que podem ser relevantes estão omissos ou incompletos nos processos clínicos), com uma amostra relativamente pequena, compreendendo 11 anos no tempo (o que implica, por exemplo, abordagens/critérios cirúrgicos diferentes, técnicas diferentes, material protésico de substituição diverso, doentes com comorbilidades múltiplas mais graves e cada vez mais frequentes, meios complementares de diagnóstico e cuidados pós‐operatórios intensivos certamente diferentes e com impacto na qualidade de cuidados prestados e com repercussão no outcome mortalidade intra‐hospitalar). Dos dados relevantes, faltam certamente vários relacionados com o ato cirúrgico em si: tempos de cirurgia, de cardioplegia, de circulação extracorporal e de clampagem aórtica; extensão do desbridamento/resseção de tecidos intracardíacos, incluindo tecido paravalvular/possível envolvimento do tecido de condução e/ou do annulus valvular, uso de patches de Dacron, esquema de hipotermia. Faltou ainda, por exemplo, tempo de antibioticoterapia pré‐operatória e pós‐operatória, tempo de internamento noutros hospitais e o tempo de demora no internamento noutro hospital de um doente com potencial indicação cirúrgica e a efetivação da cirurgia cardíaca.
ConclusãoDos doentes com EI, 13% faleceram no período pós‐operatório. A identificação mais precoce de melhores indicadores de candidatos a cirurgia cardíaca na EI é uma necessidade real, tal como a implementação de um Heart Team [que deve incluir um cardiologista (clínico e/ou com experiência em ecocardiografia transtorácica e transesofágica), um cirurgião cardiotorácico, um internista/intensivista, um infeciologista, um neurologista, o médico de família e um imagiologista) e uma melhor estratégia cirúrgica (maior precocidade, cuidados pós‐operatórios mais específicos, antibioticoterapia otimizada entre outros aspetos) para reduzir a mortalidade intra‐hospitalar e a médio e longo prazos.
Assim, em termos práticos, deve ser colocada a hipótese de realização de cirurgia cardíaca precoce (nos primeiros 7 dias) a discutir pelo Heart Team, quando: for isolado um estafilococo nas hemoculturas, houver insuficiência cardíaca refratária ou vegetações de grandes dimensões (> 10mm), ou choque séptico e/ou cardiogénico, ou fração de ejeção do ventrículo esquerdo < 50%.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.