Importance: Familial hypercholesterolemia is characterized by impaired uptake of cholesterol in peripheral tissues, including the liver and the pancreas. In contrast, statins increase the cellular cholesterol uptake and are associated with increased risk for type 2 diabetes mellitus. We hypothesize that transmembrane cholesterol transport is linked to the development of type 2 diabetes.
Objective: To assess the association between type 2 diabetes prevalence and familial hypercholesterolemia.
Design, setting, and participants: Cross‐sectional study in all individuals (n=63,320) who underwent DNA testing for familial hypercholesterolemia in the national Dutch screening program between 1994 and 2014.
Exposures: Deleteriousness and nondeleteriousness of familial hypercholesterolemia mutations were based on literature or laboratory function testing. Low‐density lipoprotein (LDL) receptor mutations were considered more severe than apolipoprotein B gene (APOB) mutations, and receptor‐negative LDL receptor mutations were considered more severe than receptor‐deficient mutations.
Main outcomes and measures: Prevalence of type 2 diabetes.
Results: The prevalence of type 2 diabetes was 1.75% in familial hypercholesterolemia patients (n=440/25,137) vs 2.93% in unaffected relatives (n=1119/38,183) (P<.001; odds ratio [OR], 0.62 [95% CI, 0.55‐0.69]). The adjusted prevalence of type 2 diabetes in familial hypercholesterolemia, determined using multivariable regression models, was 1.44% (difference, 1.49% [95% CI, 1.24%‐1.71%]) (OR, 0.49 [95% CI, 0.41‐0.58]; P<.001). The adjusted prevalence of type 2 diabetes by APOB vs LDL receptor gene was 1.91% vs 1.33% (OR, 0.65 [95% CI, 0.48‐0.87] vs OR, 0.45 [95% CI, 0.38‐0.54]), and the prevalence for receptor‐deficient vs receptor‐negative mutation carriers was 1.44% vs 1.12% (OR, 0.49 [95% CI, 0.40‐0.60] vs OR, 0.38 [95% CI, 0.29‐0.49]), respectively (P for trend <.001 in both comparisons).
Conclusions and relevance: In a cross‐sectional analysis in the Netherlands, the prevalence of type 2 diabetes among patients with familial hypercholesterolemia was significantly lower than among unaffected relatives, with variability by mutation type. If this finding is confirmed in longitudinal analysis, it would raise the possibility of a causal relationship between LDL receptor‐mediated transmembrane cholesterol transport and type 2 diabetes.
CommentTemos uma sustentação biológica para a diabetes associada às estatinas? Pedro Marques da Silva
A redução do colesterol das LDL (LDL‐C) com as estatinas é uma das bases estruturantes da prevenção secundária e primária de eventos cardiovasculares (CV) em doentes em risco e está arrolado a reduções significativas da morbimortalidade num leque alargado de doentes (a redução de 1mmol/l [38,6mg/dl] do LDL‐C está associada à diminuição significativa de 21% de eventos major vasculares em indivíduos com ou sem diabetes)1–4. A prescrição de estatinas está também relacionada com um perfil de segurança e tolerabilidade excelente (a este propósito alvitro a leitura atenta do relatório de 2014 da NLA Task Force on Statin Safety)5,6.
No entanto, recentemente foi apontado um possível efeito diabetogénico às estatinas7,8, bastante consistente e com um aparente efeito de dependente de dose, que terminou com uma nota de ponderação por parte da US Food and Drug Administration (FDA) sobre o provável incremento dos níveis de glicemia e da HbA1c e da European Medicines Agency (EMA) acerca do aumento ligeiro do risco de diabetes tipo 2 (DMT2) com as estatinas. Este apontamento foi, recentemente, confirmado (com um risco tendencialmente mais alto do que o previamente relatado). Num coorte populacional de 8749 homens (idade: 45‐73 anos), sem DMT2, ao fim de seis anos de acompanhamento, os doentes tratados com estatinas (n=2142) tiveram um aumento do risco de DMT2 de novo de 46%, após o ajustamento para numerosos fatores potenciais de confusão (HR ajustado 1,46 [IC 95% 1,22, 1,74]). O risco foi dependente da dose e esteve arrolado a uma redução em 24% da sensibilidade à insulina e da secreção da insulina em 12%, em comparação com os indivíduos não tratados com estatinas (p<0,01)9.
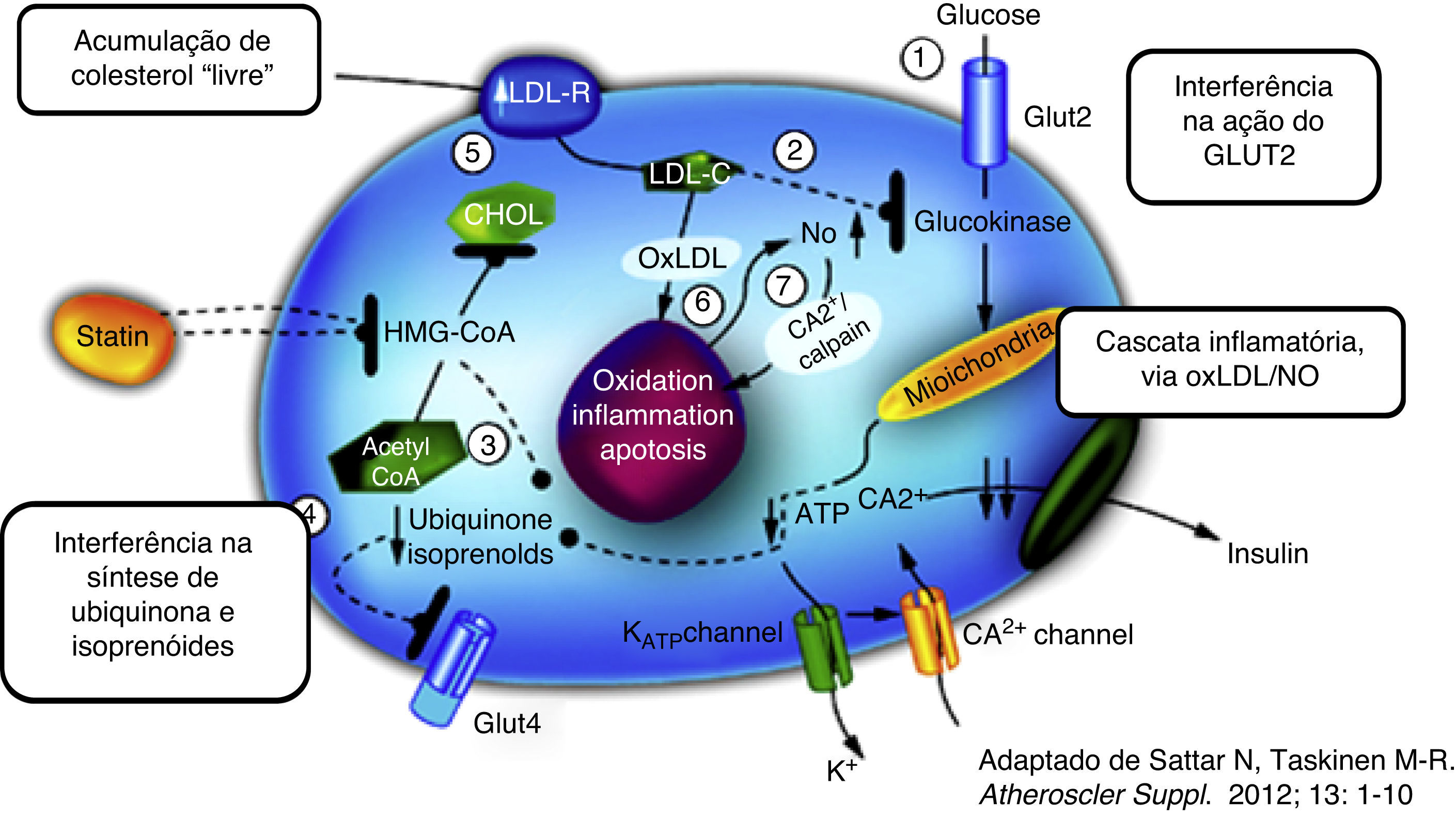
No entanto, apesar dos inúmeros mecanismos biológicos (Figura 1) que têm sido aventados para explicitar o efeito diabetogénico das estatinas6–8,10, permanece ainda desconhecido o seu elo essencial. É possível que as estatinas possam simplesmente antecipar a progressão para a DMT2 em indivíduos com fatores de risco pré‐existentes reconhecidos (e. g. síndrome metabólica, anomalia da glicemia em jejum, IMC ≥30kg/m2 ou HbA1c >6%)11. Também não se podem rejeitar fatores residuais de confusão (e. g. a ingestão de calorias e de gorduras é, pretensamente, maior nos doentes medicados com estatinas, favorecendo o aumento do peso e conferindo um pretenso sentido de segurança a quem está medicado, facilitador do não cumprimento das medidas de estilo de vida)12.
Mas, será que o risco de DMT2 incidente é intrínseco ao efeito farmacológico das estatinas (entendido, dessa forma, como um efeito inerente de classe)?
É, neste entrecho, que o artigo publicado agora é basilar13. Neste trabalho os autores sugerem que a redução ou não expressão do recetor LDL (LDLR) – base fisiopatológica das formas mais prevalentes de hipercolesterolemia familiar (HF) – está ligada a um baixo risco de DMT2. Após o ajustamento para muitos dos fatores relatados com a diabetes, os mais de 25000 doentes com confirmação genética de HF aparentaram um risco significativamente menor de DMT2 (OR, 0,62 [IC 95%, 0,55‐0,69]; p<0,001). Além disso, nas mutações expostas a uma maior atenuação da produção do LDLR a redução do risco de DMT2 foi mais acentuada. Depreende‐se que o número elevado de doentes analisados e o caráter aleatório genético das mutações envolvidas limitam, de forma importante, a turvação dos resultados por fatores de confusão não identificados (reforçando, assim, a importância dos dados).
Dizemos, então, que o tratamento com estatinas está intimamente relacionado com a maior produção de LDLR (no hepatócito, mas também em todas as células nucleadas). A maior captação/depuração de colesterol (causado pelas estatinas) nas células β pancreáticas (com consequência da maior expressão de recetores) poderiam diminuir a secreção de insulina (Figura 1). Os doentes com HF, com menor produção do LDLR, teriam, por isso, uma redução do risco de incidência de DMT2.
Interessante a hipótese, curiosamente apoiada num outro estudo recente de aleatorização mendeliana, robustecedor de uma aparente causalidade biológica14. Neste estudo foram identificados dois polimorfismos de nucleótido único (SNP) próximos ou íntimos do gene codificador da redutase do HMG CoA (HMGCR) – enzima central da síntese endógena do colesterol, inibida pelas estatinas – relacionados com valores baixos de LDL‐C, por isso, tidos como proxy (representante) da inibição da HMGCR. Em 43 estudos observacionais genéticos (<220000 indivíduos) ambos os SNP – a par da redução do LDL‐C – estiveram expostos a uma maior incidência e prevalência de DMT2 (mas, também, a aumentos do peso e do índice de massa corporal e de maiores níveis plasmáticos de glicose e insulina).
Novos estudos serão necessários para clarificarmos – de forma sustentada – um processo que pode, naturalmente, ser diversificado e multifatorial. Será necessário, por exemplo, saber se a DMT2 associada a estatinas é reversível. Se não for, em que medida este efeito condiciona a estratégia terapêutica em doentes com maior risco de diabetes ou com indicação marginal para o uso de estatinas?
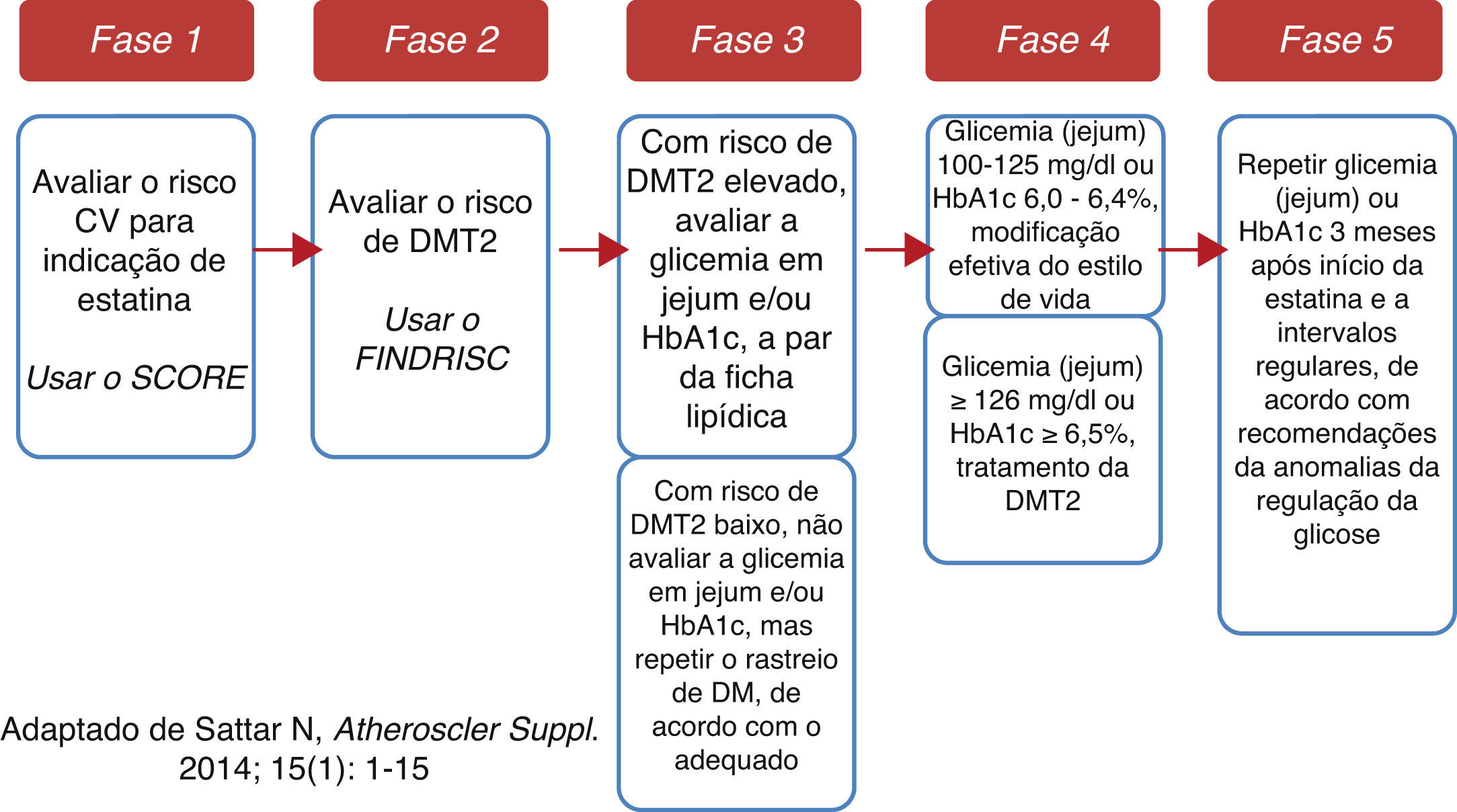
Entretanto, o balanço de benefício‐risco continua indubitavelmente favorável ao início de estatinas em doente com indicação para tal7,8. Antes da introdução da estatina, devemos avaliar – de forma sustentada – o risco individual de desenvolvimento de DMT27 (acessível em http://www.spd.pt/images/avaliacao.pdf) e informar (e instruir) o doente acerca desses riscos (CV e DMT2), estimulando‐o a iniciar e a manter medidas de estilo de vida adequadas (nomeadamente nos doentes com anomalias da regulação da glicose). Os doentes tratados com estatinas e maior risco de DMT2 devem ser avaliados regularmente (com monitorização periódica da glicemia e da HbA1c) (Figura 2). Se, entretanto, sobrevier uma DMT2, o médico deve continuar a estatina e iniciar o tratamento adequado da diabetes de acordo com a melhor prática médica7,15,16.