A angioplastia pulmonar por balão (BPA) constitui uma alternativa terapêutica na hipertensão pulmonar tromboembólica crónica (HPTEC) inoperável ou hipertensão pulmonar (HP) residual/recorrente após cirurgia. O objetivo deste estudo foi avaliar a eficácia e segurança a curto prazo do programa de BPA.
MétodosEstudo prospetivo em centro único, que incluiu todas as sessões de BPA em doentes com HPTEC entre 2017 a 2019. Realizou‐se avaliação da classe funcional da OMS, biomarcadores plasmáticos, teste de marcha de 6 minutos (TM6M) e cateterismo cardíaco direito no início e seis meses após a última sessão.
ResultadosForam realizadas 57 sessões de BPA em 11 doentes com HPTEC (64% doença inoperável, 82% sob terapêutica vasodilatadora pulmonar). O programa de BPA foi concluído com um seguimento mínimo de seis meses em nove doentes. Houve uma melhoria significativa na classe funcional OMS (p = 0,004), no TM6M (aumento médio de 42 metros; p = 0,050) e uma tendência para melhoria hemodinâmica significativa: queda de 25% na pressão da artéria pulmonar média (PAPm; p = 0,082) e 42% na resistência vascular pulmonar (RVP; p = 0,056). No subgrupo de doentes que apresentavam critérios hemodinâmicos de gravidade (três doentes com PAPm > 40mmHg), a redução foi significativa: 51% na PAPm (p = 0,013) e 67% na RVP (p = 0,050). Foram suspensos os análogos da prostaciclina e a oxigenoterapia de longa duração em todos os doentes. Foram registadas complicações minor em 25%. Não foram registadas complicações major ou mortes.
ConclusõesUma estratégia de BPA em doentes sob terapêutica vasodilatadora pulmonar melhora os sintomas, a capacidade de exercício e a hemodinâmica com uma relação risco‐benefício aceitável em doentes com HPTEC inoperável ou HP residual/recorrente após cirurgia.
Balloon pulmonary angioplasty (BPA) is an alternative therapy in patients with inoperable chronic thromboembolic pulmonary hypertension (CTEPH) or residual/recurrent pulmonary hypertension (PH) after surgery. The aim of this study was to assess the short‐term efficacy and safety of a BPA program.
MethodsThis prospective single‐center study included all BPA sessions performed in CTEPH patients between 2017 and 2019. Clinical assessment including WHO functional class, plasma biomarkers, 6‐min walk test (6MWT) and right heart catheterization was performed at baseline and six months after the last BPA session.
ResultsA total of 57 BPA sessions were performed in 11 CTEPH patients (64% with inoperable disease, 82% under pulmonary vasodilator therapy). Nine patients completed both the BPA program and a minimum six‐month follow‐up period. There were significant improvements in WHO functional class (p=0.004) and 6MWT (mean increase of 42 m; p=0.050) and a trend for significant hemodynamic improvement: 25% decrease in mean pulmonary artery pressure (mPAP) (p=0.082) and 42% decrease in pulmonary vascular resistance (PVR) (p=0.056). In the group of patients with severely impaired hemodynamics (three patients with mPAP >40mmHg), the reduction was significant: 51% in mPAP (p=0.013) and 67% in PVR (p=0.050). Prostacyclin analogs and long‐term oxygen therapy were withdrawn in all patients. Minor complications were recorded in 25% of patients. There were no major complications or deaths.
ConclusionsA BPA strategy on top of pulmonary vasodilator therapy further improves symptoms, exercise capacity and hemodynamics with an acceptable risk‐benefit ratio in patients with inoperable CTEPH or residual/recurrent PH after surgery.
A hipertensão pulmonar tromboembólica crónica (HPTEC) é uma doença crónica, progressiva, que se caracteriza pela obstrução da vasculatura arterial pulmonar por material trombótico organizado, com consequente reação fibrótica, espessamento da íntima, remodelling vascular e lesões plexiformes condicionando elevação das resistência e pressão na circulação pulmonar, hipertensão pulmonar grave, sobrecarga do coração direito, falência do ventrículo direito e morte1–6. Associa‐se a mau prognóstico quando tratada apenas medicamente, com uma sobrevida a 1‐, 3‐ e 5 anos de 90,2%, 78,4% e 64,5%, respetivamente7. A cirurgia de endarterectomia arterial pulmonar (EAP) é a terapêutica de primeira linha que, quando realizada em centros com experiência, apresenta uma taxa de mortalidade hospitalar inferior a 5% e confere melhoria hemodinâmica e funcional com boa sobrevida em longo prazo8,9. No entanto, menos de 60% dos doentes são considerados elegíveis para a cirurgia10–12. Os motivos para inelegibilidade cirúrgica incluem fatores relacionados com a localização mais distal da doença (doentes tecnicamente inoperáveis) ou fatores relacionados com o doente e as suas comorbilidades (tecnicamente operáveis, mas com um risco/benefício cirúrgico desfavorável)10. Adicionalmente, até 50% dos doentes operados mantém hipertensão pulmonar residual ou recorrente com consequente impacto na morbilidade e mortalidade12–14. A terapêutica farmacológica com riociguat, um estimulador da guanilato ciclase solúvel, melhora a hemodinâmica e a capacidade de exercício nestes doentes, mas não é curativa15–17. Neste contexto, a angioplastia pulmonar por balão (BPA), procedimento endovascular que permite dilatar as artérias pulmonares estenóticas ou obstruídas, surge como uma opção terapêutica emergente para doentes com HPTEC que não são elegíveis para cirurgia ou que têm hipertensão pulmonar recorrente ou persistente após EAP12.
Após o primeiro caso clínico relatado em 198818, a primeira série de casos sobre BPA no tratamento da HPTEC foi publicada por Feinsten et al. em 200119. A técnica mostrou ser eficaz com descida da pressão arterial pulmonar (PAP) média e melhoria da classe funcional, mas com uma elevada taxa de complicações, principalmente lesão pulmonar de reperfusão fatal e necessidade de ventilação mecânica19, o que levou a que a técnica fosse abandonada durante uma década.
A técnica redefinida reemergiu em 2012 após alguns centros no Japão20–22 terem publicado séries a relatar maior segurança do procedimento e simultaneamente melhoria da clínica e hemodinâmica pulmonar. Estes resultados favoráveis foram confirmados num registo multicêntrico japonês23 que incluiu 308 doentes com HPTEC tratados com BPA em 1408 sessões divididas por sete centros. Verificou‐se uma melhoria hemodinâmica significativa com descida das resistências vasculares pulmonares (RVP) em mais de 50% e com uma sobrevida global a um e três anos sobreponível à cirurgia (96,8% e 94,5%, respetivamente).
Na Europa, o número de centros que iniciaram o programa de BPA tem crescido exponencialmente nos últimos anos24–28. Recentemente, foi publicada a maior casuística reunida num centro único francês, que incluía 184 doentes submetidos a 1006 sessões de BPA confirmando a melhoria significativa em curto prazo dos sintomas, capacidade de exercício e hemodinâmica, bem como a segurança do procedimento e a manutenção da eficácia em longo prazo com uma taxa de sobrevida a três anos de 95,1%29.
Não existe até à data publicação de dados sobre a experiência portuguesa em BPA. Este estudo tem como objetivo apresentar os resultados da experiência inicial do nosso centro através da avaliação do benefício sintomático, funcional e hemodinâmico a curto prazo, bem como da segurança da técnica de BPA no tratamento de doentes com HPTEC.
MétodosSeleção da populaçãoForam incluídos doentes com HPTEC não elegíveis ou com contraindicações para EAP após avaliação de operabilidade por uma equipa multidisciplinar pertencente a um centro cirúrgico com experiência na realização de EAP, tal como recomendado pelas guidelines atuais12. Foram ainda incluídos os doentes com hipertensão pulmonar persistente ou recorrente após EAP.
Os doentes foram submetidos a um estudo diagnóstico completo incluindo história clínica e avaliação de comorbilidades, cintigrafia pulmonar de ventilação‐perfusão, angiotomografia de tórax com reconstruções biplanares, angiografia pulmonar de subtração digital e cateterismo direito. Todos os doentes deram o consentimento informado escrito aprovado pelo Comitê de Ética do Hospital Garcia de Orta e em conformidade com a Declaração de Helsínquia.
Avaliação antes e após angioplastia pulmonar por balãoTodos os doentes foram submetidos a avaliação clínica no momento do diagnóstico de HPTEC (nos doentes submetidos a EAP, a avaliação incluída nesta análise foi a efetuada depois da cirurgia), antes da primeira sessão de BPA (baseline) e seis meses após a última sessão (follow‐up). A avaliação clínica incluiu classificação funcional da Organização Mundial de Saúde (OMS), teste de marcha de 6 minutos (TM6M), níveis séricos de N‐terminal pro‐brain natriuretic peptide (NT‐proBNP), gasimetria arterial e cateterismo cardíaco direito completo (para medição de PAP média, RVP e débito cardíaco por método de termodiluição).
Técnica de angioplastia pulmonar por balãoA BPA foi realizada de acordo com metodologia adotada pelo nosso centro e previamente publicada30 (Figura 1).
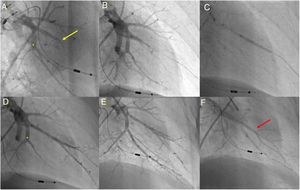
Angioplastia pulmonar com balão do segmento A7+8 do lobo inferior esquerdo. A) Angiografia pulmonar seletiva demonstrando oclusão total do segmento A8 (seta amarela) e web na bifurcação do segmento A7 (*); B) Passagem de fio guia Whisper MS (Abbot Vascular, Santa Clara, CA, USA), através da oclusão do segmento A8; C) Dilatação do vaso com balão semicomplacente Pantera Pro (Biotronik SE & Co KG, Berlin, Germany) 4.0/20mm; D) Angiografia pulmonar seletiva demonstrando um bom resultado final no nível do segmento A8 e segmento A7 ainda não abordado (*); E) Após dilatação do segmento A7 no nível da web (*) verifica‐se bom resultado angiográfico final com aumento do fluxo arterial; F) Retorno venoso presente (seta vermelha) na angiografia seletiva final do segmento A7+8 a documentar fluxo pulmonar grau 3.
Os procedimentos foram efetuados com manutenção da terapêutica de ambulatório, particularmente da terapêutica anticoagulante e dos vasodilatadores pulmonares específicos. Foram necessárias múltiplas sessões de BPA para o tratamento completo de cada doente. Nas primeiras sessões, priorizou‐se o tratamento de lesões menos complexas como estenoses, webs e lesões suboclusivas. Oclusões totais e lesões em vasos tortuosos foram abordadas com menos frequência. Nos doentes com hemodinâmica mais grave (PAP média > 40mmHg e/ou RVP > 7 Unidades de Wood), houve um subdimensionamento do diâmetro do balão ao vaso, sobretudo nas primeiras sessões e usaram‐se técnicas de avaliação funcional como pressure‐wire‐guided BPA31. O número total de segmentos tratados em cada sessão variou de acordo com a gravidade hemodinâmica do doente, o tempo do procedimento (< 60 minutos de fluoroscopia) e a quantidade de contraste iodado utilizado (< 300ml ou menos dependendo da função renal basal).
Sempre que possível, cada doente foi submetido a duas sessões de BPA no mesmo internamento. As sessões subsequentes de BPA foram programadas com 3‐4 semanas de intervalo até à PAP média descer abaixo de 25 mmHg e/ou RVP descer abaixo de 4 unidades de Wood
(uWood), sob terapêutica vasodilatadora pulmonar e/ou até todas as lesões acessíveis
serem intervencionadas..
Análise de segurançaAs complicações relacionadas com a BPA foram definidas como: 1) lesão vascular angiográfica (incluindo dissecção e perfuração vascular); 2) hemoptises; 3) lesão pulmonar cuja gravidade foi classificada em cinco graus utilizando um sistema de classificação previamente publicado na literatura32; 4) complicações do local de acesso vascular (incluindo hematoma ou seroma); 5) nefropatia de contraste definida como um aumento de 25% ou de 0,5mg/dL comparativamente ao valor de creatininemia prévio ao procedimento33. Para deteção precoce de potenciais complicações, os doentes foram submetidos à realização de avaliação laboratorial e radiografia de tórax às 24 e 48 horas pós‐procedimento.
Definimos complicações major relacionadas com o procedimento como lesão pulmonar de grau maior ou igual a três ou outras complicações que requereram intervenção, ventilação não invasiva com pressão positiva, ventilação mecânica, suporte circulatório mecânico (ECMO) ou que resultaram na morte do doente.
As complicações foram adjudicadas por um cardiologista de intervenção e dois peritos em hipertensão pulmonar.
Análise de eficáciaO sucesso do programa de BPA foi avaliado aos seis meses através da medição invasiva da hemodinâmica da vasculatura pulmonar (PAP média e RVP) e através de parâmetros clínicos que permitiram avaliar a tolerância ao exercício (classe funcional da OMS e TM6M).
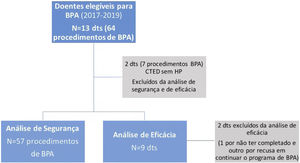
As complicações (dados de segurança) foram avaliadas em todos os procedimentos de BPA nos doentes com HPTEC. Os resultados de eficácia foram avaliados em todos os doentes com HPTEC que cumpriram todas as sessões programadas de BPA e que realizaram o cateterismo de seguimento aos 6 meses após a última sessão de BPA (Figura 2 – flow chart).
Análise estatísticaA análise estatística foi realizada utilizando o software IBM SPSS Statistics 25.0 (IBM Corp, Armonk, NY, USA). As variáveis categóricas foram apresentadas por números (n) e percentagens (%) e as variáveis contínuas através da média ± desvio‐padrão (se distribuição normal) ou mediana e interquartil range (IQR, se distribuição não normal). Para comparações, foram utilizados quando apropriado o teste de qui‐quadrado, teste exato de Fisher e teste de McNemar (se variáveis categóricas) e o teste t de Student emparelhado ou o teste não paramétrico de Wilcoxon para amostras emparelhadas (se variáveis contínuas). A análise foi realizada para um nível de significância de 5%.
ResultadosCaracterização da populaçãoEntre dezembro de 2017 e novembro de 2019 (23 meses), foram realizadas 64 sessões de BPA em 13 doentes, 57 das quais em doentes com o diagnóstico de HPTEC. As restantes sessões foram realizadas em doentes com doença pulmonar tromboembólica crónica sem hipertensão pulmonar, pelo que foram excluídas da análise.
As 57 sessões incluídas foram efetuadas em 11 doentes com o diagnóstico de HPTEC: idade média 66 ± 12 anos, 73% do género feminino. História prévia de tromboembolismo venoso agudo foi reportada em oito doentes (73%). No momento do diagnóstico de HPTEC, todos os doentes tinham limitação das atividades de vida diária (100% classe funcional OMS ≥ II e dois doentes em classe funcional IV). O valor mediano de NT‐proBNP era de 538 (192‐1255) pg/mL e a distância média percorrida na TM6M foi de 326 ± 138 metros. Todos os doentes estavam sob terapêutica anticoagulante, 82% sob terapêutica vasodilatadora pulmonar (incluindo dois doentes sob análogos das prostaciclinas) e dois (18%) sob oxigenioterapia de longa duração.
Na avaliação hemodinâmica antes da primeira sessão de BPA, a PAP média era 33,5 ± 11,8mmHg e a RVP 5,0 ± 3,2 uWood. Três doentes (27%) apresentavam hemodinâmica gravemente comprometida (PAP média superior a 40mmHg): PAP média 50,3 ± 0,6mmHg e RVP 8,5 ± 3,6 uWood.
A principal indicação para integração em programa de BPA foi a não elegibilidade para cirurgia de EAP (sete doentes, 64%), em quatro doentes foi por doença de predomínio distal, dois por risco‐benefício para EAP desfavorável e um recusou cirurgia. Nos doentes inoperáveis, o tempo mediano entre o diagnóstico de HPTEC e a primeira sessão de BPA foi de 10 (3‐58) meses. Quatro doentes (36%) integraram o programa de BPA por hipertensão pulmonar residual ou recorrente pós‐cirurgia. O tempo mediano entre a EAP e a primeira sessão de BPA nestes doentes foi de 58 (19‐78) meses.
As características clínicas e hemodinâmicas basais (avaliação antes da primeira sessão de BPA) encontram‐se resumidas na Tabela 1.
Características clínicas basais e do procedimento
| (n = 11 doentes, | |
|---|---|
| 57 procedimentos) | |
| Características clínicas | |
| Idade, anos | 66 ± 12 |
| Mulheres, n (%) | 8 (73%) |
| História de TEV aguda, n (%) | 8 (73%) |
| Classe funcional WHO I/II/III/IV, n (%) | 0/ 9 (82%)/ 2 (18%)/ 0 |
| TM6M, metros | 407 ± 62 |
| NT‐proBNP, pg/mL | 204 (118‐602) |
| PaO2, mmHg | 67 ± 21 |
| Oxigenioterapia, n (%) | 2 (18%) |
| Características hemodinâmicas# | |
| PAP sistólica, mmHg | 54,1 ± 20,0 |
| PAP diastólica, mmHg | 21,6 ± 5,8 |
| PAP média, mmHg | 33,5 ± 11,8 |
| PAD média, mmHg | 5,4 ± 2,9 |
| PECP, mmHg | 9,5 ± 2,2 |
| RVP, uWood | 5,0 ± 3,2 |
| Débito cardíaco, L/min | 5,0 ± 1,1 |
| Índice cardíaco, L/min/m2 | 2,8 ± 0,6 |
| SvO2, % | 66,0 ± 8,6 |
| Terapêutica vasodilatadora pulmonar | 9 (82%) |
| Estimuladores da guanilato ciclase solúvel, n (%) | 7 (64%) |
| Antagonistas do recetores da endotelina, n (%) | 4 (36%) |
| Inibidores da fosfodiesterase tipo 5, n (%) | 2 (18%) |
| Análogos das prostaciclinas, n (%) | 2 (18%) |
| Medicação (sem/monoterapia/dupla/tripla), n (%) | 2 (18%)/ 5 (46%)/ 3 (27%)/ 1 (9%) |
| Indicações para a BPA | |
| Recusa tromboendarterectomia pulmonar, n (%) | 7 (64%) |
| Hipertensão pulmonar residual pós‐cirurgia, n (%) | 4 (36%) |
| Características do procedimento | |
| Número de sessões BPA, n | 57 |
| Número de sessões por doente, n | 5,4 ± 1,9 |
| Número de segmentos tratados por sessão, n | 2,4 ± 1,0 |
| Número de vasos tratados por sessão, n | 3,9 ± 1,7 |
| Número de balões por sessão, n | 3,8 ± 1,1 |
| Pulmão abordado (direito/esquerdo/ambos), n 35/16/6 | |
| Tipo de lesões por sessão, n | |
| Web | 2,7 ± 1,7 |
| Estenose | 0,3 ± 0,6 |
| Oclusão sub‐total | 0,5 ± 0,7 |
| Oclusão total | 0,3 ± 0,7 |
| Contraste por sessão, ml | 267 ± 78 |
| Tempo médio de fluoroscopia, min | 61 ± 15 |
BPA – Angioplastia pulmonar por balão; PAP – Pressão arterial pulmonar; PECP – Pressão de encravamento capilar pulmonar; TM6M – Teste de marcha de 6 minutos; RVP – Resistências vasculares pulmonares; SvO2 – Saturação de oxigénio venosa mista; TEV – Tromboembolismo venoso; WHO – World Heath Organization
#Características hemodinâmicas basais imediatamente antes da realização da primeira sessão de BPA
Num total de 57 sessões, foram realizadas em média 5,4 ± 1,9 sessões por doente. Foram tratados 220 vasos e 135 segmentos com uma média de 3,9 ± 1,7 vasos e 2,4 ± 1,0 segmentos por sessão. Por doente foram tratados em média 21,1 ± 8,8 vasos e 10,0 ± 2,4 segmentos. Webs, oclusões subtotais, oclusões totais e estenoses foram intervencionadas, respetivamente, em 153 (69,5%), 31 (14,1%), 19 (8,6%) e 17 (7,7%) dos vasos tratados. O pulmão direito (n = 35; 61,4%) e, particularmente, o segmento A10 (n = 20, 35,1%) do lobo inferior direito foram os mais frequentemente intervencionados. A imagem intravascular foi utilizada em cinco sessões (8,8%). A avaliação funcional com fio de pressão foi utilizada para guiar 10 procedimentos (17,5%), maioritariamente em casos com hemodinâmica grave (média da PAP média e da RVP nesses procedimentos foi de 41,7 ± 9,0mmHg e 6,5 ± 2,6 uWood, respetivamente). O tempo médio de procedimento foi 124 ± 30 minutos, o tempo médio de fluoroscopia incluindo o cateterismo cardíaco direito foi de 61 ± 15 minutos e o volume médio de contraste utilizado de 267 ± 78mL por sessão.
Análise de segurança (complicações do procedimento)A taxa de complicações relacionada com o procedimento foi de 24,6% (Tabela 2). Lesões vasculares foram observadas em seis sessões (10,5%): três perfurações distais pelo fio guia acompanhadas de hemoptises ligeiras e três dissecções. Para tratamento de duas das três perfurações foi necessária insuflação de balão prolongada, que permitiu resolução completa da lesão. A perfuração excedente e as dissecções resolveram sem qualquer intervenção percutânea ou cirúrgica. A presença de hemoptises foi registada em seis sessões (10,5%) e a lesão pulmonar ocorreu em três (5,3%), tendo sido caracterizada como de gravidade ligeira (grau 2) e sem necessidade de ventilação mecânica invasiva ou ECMO. Complicação do acesso vascular e nefropatia de contraste ocorreram em apenas uma sessão cada (1,8%). Nenhum doente apresentou dermatite aguda induzida pela radiação. Não ocorreu complicação major relacionada com o procedimento e não se registou qualquer morte periprocedimento.
Complicações (n = 57 sessões)
| Evento | Total (n, % sessões) |
|---|---|
| Lesão vascular | 6 (10,5) |
| Perfuração | 3 (5,3) |
| Dissecção | 3 (5,3) |
| Hemoptises | 6 (10,5) |
| Lesão pulmonar | 3 (5,3) |
| Grau ≥ 3 | 0 |
| Ventilação mecânica | 0 |
| Suporte mecânico circulatório (ECMO) | 0 |
| Lesão do local de acesso vascular | 1 (1,8) |
| Nefropatia de contraste | 1 (1,8) |
| Outra | 2 (3,5) |
| Morte intrahospitalar | 0 |
| Complicações no globala | 14 (24,6) |
Dos nove doentes que completaram o programa de BPA, 89% encontravam‐se sob terapêutica vasodilatadora pulmonar. O tempo mediano entre o diagnóstico de HPTEC e a primeira sessão de BPA nestes doentes foi de 55 (8‐69) meses.
Foi possível com a terapêutica vasodilatadora pulmonar uma redução do número de doentes em classe funcional avançada (dois doentes em classe funcional OMS IV transitaram para classe III e dois doentes em classe III para classe II). Deste modo, antes de iniciar o programa de BPA nenhum doente se encontrava em classe funcional IV (Tabela 3). Registou‐se uma melhoria do TM6M (aumento médio de 60 metros; p = 0,208), embora sem atingimento de significado estatístico (não foi possível a realização desta prova no momento inicial em dois doentes com classes funcionais mais avançadas). Houve um decréscimo do valor de NT‐ProBNP (mediana de 538 versus 204 pg/mL; p = 0,156), embora sem significado estatístico. Em termos de resultados hemodinâmicos, verificou‐se uma diminuição significativa de aproximadamente 20% dos valores de PAP média (43,4 ± 11,3 versus 34,8 ± 12,5mmHg, p = 0,018) e uma redução de 48% dos valores de RVP (10,2 ± 4,5 versus 5,3 ± 3,4 uWood, p = 0,001). A terapêutica vasodilatadora pulmonar também permitiu aumentar de forma significativa o índice cardíaco (2,2 ± 0,6 versus 2,7 ± 0,6 L/min/m2, p = 0,041).
Características clínicas e hemodinâmicas (n = 9 doentes)
| Variáveis | Inicial Momento do diagnóstico | Basal Momento de início BPA | 6 meses seguimento | Inicial versus basal p‐valor | Basal vs. 6 meses seguimento p‐valor |
|---|---|---|---|---|---|
| Características clínicas | |||||
| Classe funcional WHO I/II/III/IV | 0/5/2/2 | 0/7/2/0 | 9/0/0/0 | p = 0,125 | p = 0,004 |
| TM6M (m) | 360 ± 138 | 420 ± 51 | 462 ± 55 | p = 0,208 | p = 0,050 |
| NT‐proBNP (pg/mL) | 538 (314‐1089) | 204 (112‐585) | 202 (116‐392) | p = 0,156 | p = 0,652 |
| Características hemodinâmicas | |||||
| PAP sistólica (mmHg) | 69,3 ± 19,3 | 55,1 ± 21,3 | 43,4 ± 14,6 | p = 0,028 | p = 0,144 |
| PAP diastólica (mmHg) | 27,3 ± 8,3 | 22,9 ± 5,3 | 16,6 ± 5,3 | p = 0,054 | p = 0,062 |
| PAP média (mmHg) | 43,4 ± 11,3 | 34,8 ± 12,5 | 26,0 ± 6,4 | p = 0,018 | p = 0,082 |
| PAD média (mmHg) | 7,6 ± 4,4 | 5,0 ± 3,0 | 6,8 ± 2,6 | p = 0,196 | p = 0,191 |
| PECP (mmHg) | 10,0 ± 3,6 | 9,1 ± 2,1 | 11,7 ± 4,4 | p = 0,426 | p = 0,052 |
| RVP (uWood) | 10,2 ± 4,5 | 5,3 ± 3,4 | 3,1 ± 1,5 | p = 0,001 | p = 0,056 |
| Débito cardíaco (L/min) | 4,5 ± 1,4 | 5,0 ± 1,2 | 5,0 ± 1,4 | p = 0,128 | p = 0,849 |
| Índice cardíaco (L/min/m2) | 2,2 ± 0,6 | 2,7 ± 0,6 | 3,0 ± 1,0 | p = 0,041 | p = 0,501 |
| SvO2 (%) | 63,7 ± 9,8 | 65,4 ± 9,0 | 70,5 ± 5,0 | p = 0,631 | p = 0,087 |
| Alteração da PAPm em valor absoluto (mmHg) | ‐ 8,7 ± 8,7* | ‐ 8,8 ± 13,3 | p = 0,985 | ||
| Alteração da RVP em valor absoluto (uWood) | ‐4,9 ± 2,7* | ‐ 2,2 ± 3,0# | p = 0,051 | ||
BPA – Angioplastia pulmonar de balão; PAP – Pressão arterial pulmonar; PAPm – pressão arterial pulmonar média; PECP – Pressão de encravamento capilar pulmonar; TM6M – Teste de marcha de 6 minutos; RVP – Resistências vasculares pulmonares; SvO2 – Saturação de oxigénio venosa mista; WHO – World Health Organization
O tempo mediano decorrente entre a primeira e a última sessão de BPA foi de quatro meses (4‐5) meses. O seguimento a seis meses foi completado em 9 dos 11 doentes, os quais foram incluídos na análise de eficácia. Uma doente com 82 anos foi excluída da análise de eficácia por ter recusado continuar o programa de BPA após a sua segunda sessão ter resultado em complicações não major (incluídas na análise de segurança) e outra doente por não ter completado os seis meses de seguimento, após finalizado o programa de BPA, à data de publicação do estudo.
Nos nove doentes que completaram o programa de BPA, a média de sessões foi de 5,8 ± 1,6 (mediana de 5,0). Por doente, o número de segmentos e vasos tratados na totalidade das sessões foi de 10,4 ± 2,1 e 22,6 ± 7,9, respetivamente. Os efeitos clínicos, laboratoriais e hemodinâmicos a 6 meses estão sistematizados na Tabela 3 e Figura 3.
Todos os doentes apresentaram melhoria estatisticamente significativa da capacidade funcional avaliada subjetiva e objetivamente. A primeira, determinada através da classe funcional da OMS, traduziu‐se na ausência de limitação da atividade física habitual (classe funcional I) aos seis meses após a última sessão de BPA (0 versus 100% dos doentes em classe funcional I, p = 0,004). A última, avaliada pelo TM6M, refletiu‐se na melhoria em média de 42 metros da distância percorrida (420 ± 51 versus 462 ± 55, p = 0,050). Foi ainda possível a suspensão da oxigenioterapia e dos análogos das prostaglandinas em 100% dos doentes previamente medicados. No entanto, não se verificaram diferenças estatisticamente significativas nos níveis séricos de NT‐proBNP. Nenhuma morte foi registada no período de seguimento.
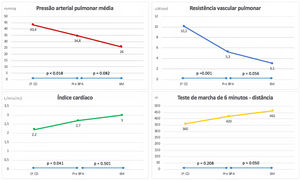
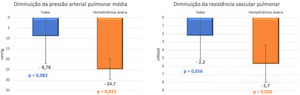
Em termos de resultados hemodinâmicos, verificou‐se uma diminuição de 25% dos valores de PAP média (34,8 ± 12,5 versus 26,0 ± 6,4mmHg, p = 0,082) e uma redução de 42% dos valores de RVP (5,3 ± 3,4 versus 3,1 ± 1,5 uWood, p = 0,056), com tendência estatística ainda que não atingindo o nível de significância proposto. Não houve diferenças significativas no índice cardíaco (2,7 ± 0,6 versus 3,0 ± 1,0, p = 0,501 L/min/m2). No entanto, quando analisado separadamente o grupo de doentes com hemodinâmica grave (PAP média > 40mmHg) no início do programa de BPA (Figura 4), observou‐se uma melhoria estatisticamente significativa da PAP média (50,3 ± 0,6 versus 24,7 ± 5,5mmHg, p = 0,013) e da RVP (8,5 ± 3,6 versus 2,8 ± 1,3 uWood, p = 0,050).
Comparação da variação média da pressão arterial pulmonar média e resistência vascular pulmonar entre a primeira sessão de angioplastia pulmonar com balão e os seis meses de follow‐up entre todos os doentes submetidos ao procedimento (n = 9) e os doentes com hemodinâmica severa (PAP média > 40mmHg) no início do programa de angioplastia pulmonar com balão (n = 3). Verifica‐se uma redução superior da pressão arterial pulmonar média e resistência vascular pulmonar atingindo significância estatística nos doentes com hemodinâmica severa na baseline.
No presente estudo, reportamos a experiência inicial do centro e, simultaneamente, os primeiros dados nacionais disponíveis do tratamento de HPTEC com recurso a BPA. O Hospital Garcia de Orta tornou‐se Centro de Referência de Hipertensão Pulmonar em 2014 e iniciou a sua experiência de BPA em dezembro de 2017 sob a orientação técnico‐científica de peritos internacionais pertencentes a centros de elevado volume em França e no Japão. Em todos os doentes, a elegibilidade para BPA foi decidida em equipa multidisciplinar, conforme recomendado pelas guidelines atuais12.
Os nossos resultados reafirmam a eficácia da técnica no tratamento de doentes com HPTEC inoperáveis ou com hipertensão pulmonar residual ou recorrente pós‐cirurgia. Sob terapêutica vasodilatadora pulmonar aprimorada, a estratégia de BPA conseguiu uma melhoria adicional da classe funcional e da capacidade de exercício com resultados que foram significativos em curto prazo. Todos os doentes se encontraram sem limitação da atividade física habitual aos seis meses de seguimento, apresentando um aumento médio de 42 metros da distância percorrida no TM6M. Foi ainda possível a suspensão de oxigenioterapia e dos análogos das prostaglandinas em 100% dos doentes com a correspondente melhoria da qualidade de vida e redução dos custos associados a estas terapêuticas. Globalmente, observámos uma tendência na melhoria dos parâmetros hemodinâmicos (PAP média e RVP). A melhoria hemodinâmica refletida pela percentagem de redução da PAP média no nosso estudo (25%) foi semelhante à recentemente reportada na série francesa29 com uma redução da PAP média de 26% e superior à série alemã28 com 18%. Não obstante, a redução foi menos pronunciada do que a observada no registo japonês23 onde se verificou uma redução média de 44%. Relativamente à RVP, demonstrou‐se uma redução de 42%, sobreponível à do registo francês29 que foi de 43%, superior aos 26% do registo alemão28 e inferior aos 66% do registo japonês23.
Existem múltiplas explicações possíveis para as diferenças encontradas entre a nossa série e o registo multicêntrico japonês: 1) experiência dos centros no Japão largamente superior e maior dimensão amostral no respetivo registo multicêntrico com 308 doentes intervencionados23 (contrariamente na série francesa, embora a dimensão amostral com 154 doentes29 tenha sido superior à nossa, os resultados hemodinâmicos foram sobreponíveis); 2) diferenças nas populações estudadas, por exemplo, maior incidência de tromboembolismo venoso agudo sintomático na nossa série (73% na nossa série e na série francesa29 comparativamente com 35% na série japonesa23); a hipótese de poder haver um fenótipo vascular mais trombótico inflamatório nos doentes europeus com HPTEC comparativamente com os japoneses, diferenças que podem determinar diferentes respostas à terapêutica34; diferente seleção dos doentes para BPA, uma vez que a menor experiência cirúrgica nos centros japoneses determina que muitos doentes submetidos a BPA no Japão são considerados operáveis em centros europeus35, contrariamente à maioria dos doentes submetidos a BPA no nosso estudo que foram inoperáveis ou pós‐cirúrgicos; 3) intervalo relativamente longo entre o diagnóstico de HPTEC e a primeira sessão de BPA (mediana de 55 meses no nosso estudo), é possível que alguns doentes tenham desenvolvido arteriopatia pulmonar periférica, a qual poderá mitigar o resultado hemodinâmico das sessões de BPA; 4) a grande maioria dos doentes (82%) encontrava‐se sob terapêutica vasodilatadora pulmonar à data de início do programa de BPA comparativamente com 72% dos doentes da série japonesa23 e 62% dos doentes da séria francesa29. A melhoria estatisticamente significativa das variáveis hemodinâmicas entre o momento do diagnóstico e o início do programa de BPA por efeito da terapêutica vasodilatadora pulmonar pode reduzir o benefício absoluto observado com a técnica percutânea.
Comparativamente com a série alemã, os resultados hemodinâmicos da nossa série foram superiores, podendo ser explicado pelo número de vasos tratados (a mediana de sessões por doente foi relativamente semelhante entre as séries, mas média de 3,9 vasos tratados por sessão na nossa série comparativamente com 2,0 vasos na série alemã28). Como referido por Matsubara36, para melhorar a eficácia da BPA é necessário aumentar o número de vasos tratados (aumentando o número de sessões por doente ou aumentando o número de vasos tratados em cada procedimento). Este autor refere ainda ser importante abordar lesões difíceis como oclusões, porque, apesar de poderem estar relacionadas com maior risco de complicações, o ganho hemodinâmico ao tratar estas lesões é potencialmente superior à dilatação de lesões menos estenóticas. A abordagem mais conservadora na presente série, ao evitar o tratamento de lesões muito complexas com maior risco de complicações (apenas 8,6% das lesões intervencionadas foram oclusões totais, na maior parte dos casos foram dilatadas webs), pode também ter contribuído para uma eficácia hemodinâmica inferior à observada na série japonesa.
Comparativamente às terapêuticas previamente disponíveis, os efeitos hemodinâmicos da BPA observados no nosso estudo foram globalmente inferiores aos reportados com a cirurgia de EAP, a qual reduz a PAP média em aproximadamente 40% e a RVP em aproximadamente 60%6,8,9,11. Não obstante, no subgrupo de doentes da nossa série com hemodinâmica severa, os benefícios hemodinâmicos assemelharam‐se aos da cirurgia com redução de 51% da PAP média e 67% da RVP com valores finais dentro do intervalo normal e, por isso, com potencial para normalização hemodinâmica. Estes dados colocam em discussão qual será a melhor forma de medir a eficácia da técnica de BPA nos doentes que apresentam uma hemodinâmica menos severa ou até normal. Provavelmente, nos doentes com uma hemodinâmica menos grave o efeito da terapêutica com a BPA não deve ser medido em termos de eficácia hemodinâmica em repouso, mas preferencialmente por parâmetros com o esforço, como com a prova de esforço cardiopulmonar ou até mesmo com cateterismo cardíaco direito de esforço37.
Relativamente à terapêutica médica, o perfil das alterações hemodinâmicas observadas com a BPA foi diferente das alterações hemodinâmicas relatadas com a terapêutica vasodilatadora pulmonar, dado que observámos melhorias na PAP média e na RVP com alterações muito pequenas no índice cardíaco. A terapêutica médica, pelo contrário, tende a melhorar principalmente o débito cardíaco com efeitos modestos na PAP média15–17. Possivelmente, o aumento do débito cardíaco que se observa com a terapêutica vasodilatadora pulmonar é em parte mediado pela vasodilatação sistémica38. Imediatamente antes de iniciar o programa de BPA, o índice cardíaco na presente série encontra‐se normalizado (média de 2,7 L/min/m2), logo é mais difícil demonstrar melhoria deste parâmetro.
A taxa de complicações relacionada com o procedimento foi 25%, superior às relatadas nos estudos prévios europeus: 9% na série alemã28 e 11% na série francesa29; mas inferior aos 36% do registo japonês23. Não entanto, as complicações registadas foram ligeiras sem necessidade de cuidados intensivos ou causadoras de morte. Pelo contrário, a taxa de complicações fatais variou entre 2 e 4% nos 3 estudos acima mencionados23,28,29. À semelhança da série alemã28, e de acordo com o que está descrito na literatura39–41, a complicação mais comum foi a lesão vascular pulmonar com ou sem hemorragia pulmonar, mas incidência reduzida de lesão de reperfusão (a complicação mais frequente nas séries japonesa23 e francesa29). As explicações possíveis para o número elevado de complicações minor, mas reduzido de complicações major, incluíndo lesão de reperfusão, podem relacionar‐se com: 1) registo completo de todas as complicações minor; 2) planeamento das sessões com base nas imagens de angiotomografia torácica, as quais têm sido descritas como fornecendo informações mais detalhadas das artérias pulmonares periféricas, permitindo uma avaliação mais confiável da acessibilidade, morfologia e diâmetros dos vasos, características das lesões e melhor dimensionamento dos balões de angioplastia a utilizar42,43; 3) ausência de bridging com heparinas de baixo peso molecular em doentes medicados com anticoagulantes orais diretos, o que parece estar associada com menor risco de hemorragia44; 4) utilização de terapêutica vasodilatadora pulmonar específica aprimorada na quase totalidade dos doentes antes da primeira sessão de BPA; 5) angioplastia pulmonar guiada por fio de pressão nas primeiras sessões de todos os doentes com hemodinâmica mais severa, porque foi demonstrado que PAP média e RVP mais elevadas são preditoras de risco de lesão pulmonar29. Um dos benefícios importantes da técnica do fio de pressão é que os níveis de pressão distal às lesões‐alvo podem ser controlados; outra é que é possível obviar a sobredilatação dos vasos‐alvo. Isso pode contribuir para a menor taxa de complicações angiográficas nas sessões guiadas por fio de pressão reduzindo o risco de lesões vasculares durante o procedimento, bem como o risco de lesão pulmonar de reperfusão associado45,46; 6) por último, mas não menos importante, o facto de termos iniciado o nosso programa de BPA com a técnica já aperfeiçoada22 e com base na experiência de peritos de centros de grande volume29. Como descrito, o procedimento de BPA tem uma curva de aprendizagem e a eficácia e segurança melhoram com a experiência29,35,36.
O nosso estudo apresenta várias limitações. Em primeiro lugar, é um estudo de centro único incluindo um número limitado de doentes e sessões de BPA. Em segundo lugar, uma elevada proporção dos nossos doentes (82%) encontrava‐se com pelo menos um fármaco vasodilatador pulmonar antes da primeira sessão de BPA, podendo admitir‐se que a terapêutica médica pode ter um impacto no resultado pós‐procedimento como relatado anteriormente em outros estudos22,23,47. Por fim, não foi possível (ainda) obter resultados de acompanhamento a longo prazo, necessários à avaliação da eficácia do procedimento para além dos seis meses pós‐intervenção.
ConclusãoOs dados apresentados constituem a primeira série de doentes HPTEC tratados com BPA em Portugal descrita na literatura até à data. Antes da implantação do programa de BPA no nosso centro, as alternativas terapêuticas dos doentes com HPTEC inoperável ou com hipertensão pulmonar residual ou recorrente pós‐cirurgia resumiam‐se à terapêutica médica vasodilatadora pulmonar. A operacionalização deste programa de BPA permitiu oferecer uma estratégia terapêutica adicional com benefício para este grupo de doentes. Após a implantação e operacionalização deste programa multidisciplinar, impunha‐se uma validação de resultados, tanto no nível da eficácia como no da segurança. Os resultados descritos confirmam o benefício significativo deste procedimento na hemodinâmica vascular pulmonar, assim como na sintomatologia e capacidade funcional, sustentados pelo menos até aos seis meses de seguimento. Este benefício acompanha‐se duma taxa significativa de complicações minor periprocedimento, mas ausência de complicações major ou morte associada ao procedimento. Por último, os resultados em curto e longo prazo da BPA carecem de ser adequadamente avaliados em estudo prospetivo e multicêntrico.
FinanciamentoO estudo não teve qualquer financiamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.