O défice de ferro (DeF) é uma condição prevalente em doentes com patologia cardíaca. Naqueles com insuficiência cardíaca (IC) demonstrou‐se que esse défice se associa a pior prognóstico. Existem poucos dados na literatura relativamente ao impacto prognóstico do DeF nas síndromes coronárias agudas (SCA), sendo este o principal objetivo deste estudo.
MétodosEstudo observacional retrospetivo que incluiu 817 doentes admitidos por SCA. Definiram‐se dois grupos de acordo com a presença (n = 298) ou ausência de DeF (n = 519) à admissão. O evento clínico estudado foi a ocorrência de morte ou IC grave em longo prazo. Calcularam‐se os preditores independentes de prognóstico com base na análise de regressão logística.
ResultadosVerificou‐se que 36% dos doentes tinham DeF. Estes doentes apresentaram maior taxa de mortalidade (p = 0,004) e de IC (p = 0,011) durante o follow‐up, bem como maior taxa de readmissões hospitalares (p = 0,048).
O DeF foi preditor independente de morte ou IC grave no follow‐up, a par da anemia, da disfunção do ventrículo esquerdo, da disfunção renal e da ausência de revascularização.
Além disso, o DeF permitiu estratificar adicionalmente o prognóstico dos doentes sem anemia em termos de ocorrência de morte ou IC grave e aqueles com classes de Killip mais baixas (≤ 2) em termos da ocorrência de morte.
ConclusãoO DeF foi um fator preditor independente de morte ou IC grave nos doentes admitidos com SCA e permitiu estratificar adicionalmente aqueles sem anemia ou com classes de Killip ≤ 2 à admissão.
Iron deficiency (IDef) is a prevalent condition in patients with heart disease and in those with heart failure (HF). Evidence has shown that this deficit is associated with a worse prognosis. There is only a small amount of data in the literature regarding the prognostic impact of IDef in acute coronary syndromes (ACS), which is the main objective of this study.
MethodsObservational, retrospective study which included 817 patients admitted for ACS. Two groups were defined according to the presence (n = 298) or absence of IDeF (n = 519) on admission. The clinical event under study was the occurrence of death or severe HF in long term. Independent predictors of prognosis were determined with logistic regression analysis.
Results36% of patients had IDef. These patients had a higher mortality rate (p = 0.004), higher incidence of HF (p = 0.011) during follow‐up and a higher rate of hospital readmissions (p = 0.048).
IDef was an independent predictor of death or severe HF in follow‐up, along with anemia, left ventricular dysfunction, renal dysfunction and the absence of revascularization.
Besides, IDef also enabled us to further stratify the prognosis of patients without anemia based on the occurrence of death or severe HF and those with lower Killip classes (≤2) based on the occurrence of death.
ConclusionIDef was an independent predictor of death or severe HF in patients admitted with ACS and enabled additional stratification for those without anemia on admission and in those with Killip classes ≤2.
O ferro é um micronutriente essencial em múltiplas funções celulares. Além do seu papel crítico na eritropoiese, intervém também no transporte de oxigénio, na resposta celular imunológica, adquirindo ainda particular importância ao nível mitocondrial, catalisando reações enzimáticas e regulando o metabolismo oxidativo1–6. A homeostasia do metabolismo do ferro está dependente de diversos mecanismos, sendo este obtido de duas fontes principais, a dieta e a reciclagem de eritrócitos senescentes7.
O ferro obtido pela dieta é absorvido ao nível do jejuno através de um transportador específico1,3,8. Quando o organismo necessita de ferro, este é exportado para a circulação através da ferroportina, ligando‐se à transferrina de forma a poder ser transportado no plasma1,3,8. O ferro não utilizado é armazenado no fígado, baço e na medula óssea sob a forma de ferritina1,3,8.
A ferritina está envolvida em diversos processos celulares, tanto fisiológicos como patológicos, é utilizada frequentemente como marcador sérico das reservas de ferro e, em situações de deficiência do ferro, tem um papel importante tanto no diagnóstico como no seguimento9–12.
A hepcidina é um regulador hormonal da homeostasia do ferro, é capaz de inibir a ferroportina, diminuindo a absorção do ferro ao nível gastrointestinal e, como consequência, este deixa de ser libertado pelos macrófagos e hepatócitos, o que conduz à diminuição da sua concentração no sangue e da disponibilidade para o metabolismo celular1,5,7,11,13.
O DeF é uma condição comum, podendo ser classificada como absoluta ou funcional1,5,13. O DeF absoluto é causado pela depleção dos depósitos de ferro, tem como possíveis causas a insuficiente ingestão, a má absorção gastrointestinal e/ou hemorragias; traduzindo‐se em níveis de ferritina inferiores a 100 ug/L[10,8,13]. O DeF funcional é resultado da diminuição da biodisponibilidade do ferro face à demanda, apesar de reservas com níveis adequados, devido ao aumento de produção de hepcidina1,5,8,13. Normalmente traduz‐se em níveis de ferritina entre 100‐299 ug/L e saturação de transferrina (ST) inferior a 20%1,8. A anemia pode ser resultado da depleção das reservas de ferro. No entanto, em inúmeras situações, apesar da diminuição daquelas reservas, os valores de hemoglobina encontram‐se em níveis considerados normais3. É necessária uma grande diminuição das reservas de ferro para que os níveis de hemoglobina atinjam níveis compatíveis com anemia3.
Níveis adequados de ferro adquiriram particular importância quando se verificou que tanto o seu défice como o seu excesso alteram as funções intracelulares, principalmente no nível das mitocôndrias, conduzindo a um maior stress oxidativo e a um desarranjo do metabolismo energético4,8,11.
As células com elevadas necessidades energéticas, como é o caso dos cardiomiócitos, possuem vias de sinalização adicionais em relação às células de armazenamento, aumentando a reabsorção de ferro e diminuindo o seu fluxo extracelular aquando da presença de défice1,3,4.
A fisiopatologia associada ao remodeling cardíaco no contexto de DeF ainda não está bem definida. No entanto, verificou‐se que, em ratinhos com DeF, há um aumento das dimensões do ventrículo esquerdo (VE) associado a alterações mitocondriais e da organização dos sarcómeros14,15. Além disso, a anemia com DeF causa hipoxia e fibrose cardíacas, fatores que também contribuem para a disfunção cardíaca14.
Os distúrbios do metabolismo do ferro são comuns em doentes com patologias cardíacas4,16,17. Dessas, a mais amplamente fundamentada é a insuficiência cardíaca crónica (ICC) e, nestes doentes, a causa mais comum de anemia é o DeF14,16,18,19. Segundo as recomendações atuais, todos estes doentes devem realizar estudo analítico que inclua o ferro sérico, transferrina sérica, ST e ferritina, independentemente da presença ou ausência de anemia, visto que o DeF pode estar presente muito anos antes do desenvolvimento desta4,5,20,21. O papel do ferro nesta patologia tem sido amplamente estudado nos últimos anos, estando já descrito que, quanto maior for o défice deste, mais comuns e mais graves são os eventos cardiovasculares adversos5,22.
A suplementação de ferro endovenosa está indicada aos doentes com ICC com fração de ejeção reduzida que apresentem défice de ferro tanto absoluto como funcional5,18,21,23. Apesar de poder ser considerada a suplementação de ferro por via oral, sobretudo se a condição não for aguda, instável ou sintomática, foi demonstrada a superioridade da suplementação endovenosa em relação à oral5,6,22. Esta superioridade prende‐se sobretudo com a interferência da inflamação da ICC na absorção do ferro oral (pela alteração provocada nas ações da hepcidina e ferroportina). Já foi comprovado que nos paciente com ICC com fração de ejeção reduzida, independentemente da presença de anemia, beneficiavam com a administração de carboximaltose férrica, apresentando melhoria da classe funcional NYHA e da capacidade de exercício2,8,18,21,23,24.
As síndromes coronárias agudas (SCA) fazem parte das mais frequentes causas de morte em todo o mundo25. São situações com um quadro clínico agudo compatível com isquemia miocárdica, podendo resultar em necrose dos cardiomiócitos26. A sua apresentação pode assumir várias formas; enfarte agudo do miocárdio com ou sem supradesnivelamento do segmento ST (EAMcSST ou EAMsSST) ou angina instável (AI). No entanto, todas potencialmente fatais27,28.
Ao contrário do que se tem verificado relativamente à ICC, são poucos os dados na literatura relativamente ao papel do DeF no contexto das SCA. Tendo em conta a prevalência desta entidade e a morbimortalidade a ela associada, torna‐se relevante avaliar até que ponto os distúrbios no metabolismo do ferro têm implicações prognósticas nestes doentes16,29.
O objetivo principal deste projeto de investigação foi determinar a prevalência e o impacto prognóstico do DeF nos doentes com síndromes coronárias agudas avaliando a ocorrência de morte ou desenvolvimento de IC grave. Pretendeu‐se ainda avaliar se o DeF acrescenta poder preditivo adicional na estratificação de risco dos doentes com SCA independentemente da presença de anemia.
MétodosFoi realizado um estudo observacional, de desenho longitudinal, com colheita de dados retrospetiva. Tem um componente descritivo e um componente analítico.
População e amostra em estudoA população do estudo incluiu todos os doentes internados numa unidade coronária com o diagnóstico de SCA admitidos entre julho de 2013 e junho de 2015.
Foram excluídos deste projeto todos os doentes portadores de: doença inflamatória crónica, patologia hepática crónica, doença renal crónica (DRC) terminal (estadio V da Classificação da Kidney Disease Outcomes Initiative), tumores malignos e/ou a realizar suplementação de ferro ou de eritropoetina. Estes critérios foram utilizados devido às alterações que estas condições provocam ao nível da ferritina e da eritropoiese15,30. Foram ainda excluídos os doentes sem dados analíticos relativamente aos níveis de ferro sérico, ferritina e capacidade total de fixação do ferro (CTFF).
Recolha de dadosOs doentes foram identificados através do número de processo, constituído por um código numérico. Posteriormente foi‐lhes atribuído um novo código de modo a garantir o anonimato.
A informação clínica recolhida incluiu dados demográficos e antropométricos, antecedentes pessoais (nomeadamente fatores de risco cardiovascular [FRCV], patologia cardiovascular [CV] prévia, cirurgia cardíaca prévia e/ou cateterismo de intervenção, patologia renal ou hepática, neoplasia, doença inflamatória crónica), medicação habitual (antiagregantes plaquetários, hipocoagulantes, anti‐hipertensores, antidislipidémicos, antianginosos), avaliação clínica (sinais e sintomas), dados analíticos (hemograma, leucograma, bioquímica, parâmetros inflamatórios, função renal, parâmetros da cinética do ferro), outros métodos complementares de diagnóstico e terapêutica (MCDT) (cateterismo cardíaco e ecocardiograma), tratamento realizado (terapêutica instituída e procedimentos realizados), evolução clínica durante o período de internamento e durante o período de follow‐up (nomeadamente eventos cardiovasculares major). Não foi feita avaliação da terapêutica no follow‐up.
Foi realizada a colheita de sangue para determinação dos níveis séricos de ferro, ferritina e CTFF nas primeiras 24 horas de internamento. Para obter a ST, esta foi calculada através da seguinte fórmula: ST = Ferro Sérico/CTFF x10011,19–21.
O DeF foi definido como ferritina < 100μg/l ou ferritina > 100μg/l e < 300μg/l e ST < 20%, estando desta forma contemplado tanto o défice absoluto como o funcional5,23. A anemia foi definida como hemoglobina < 13g/dl para os homens e < 12g/dl para as mulheres3,13,17.
Os dados obtidos foram registados em tabela de EXCEL® Microsoft, tendo sido posteriormente inseridos e processados no software IBM® Statistical Package for the Social Science (SPSS®) versão 22.
Análise de dadosOs doentes incluídos e sem critérios de exclusão foram divididos em dois grupos de acordo com a presença ou ausência de défice de ferro.
Para realizar a caracterização da amostra e comparar os grupos em estudo foi utilizada estatística descritiva. As variáveis categóricas foram expressas como percentagens e as variáveis contínuas como médias ± desvio‐padrão ou mediana, valores máximo e mínimo.
Para avaliar a normalidade foi aplicado o teste de Kolmogorov‐Smirnov. Tendo em conta o número de doentes da amostra e o número de doentes de cada grupo, analisou‐se o coeficiente de achatamento e o enviesamento. Valores de achatamento e enviesamento próximos de 0 permitem assumir uma distribuição normal31.
Para comparar os grupos e avaliar as diferenças entre eles, foi utilizado, para as variáveis contínuas, o teste t de Student para amostras independentes (teste paramétrico) ou o teste de Mann‐Whitney (teste não paramétrico), após se ter verificado que a variável dependente apresentava ou não uma distribuição normal, respetivamente. Como medida de effect size foi utilizado o d de Cohen para o teste de t de Student e r para o teste de Mann‐Whitney. Foi considerado para o d de Cohen um efeito pequeno para valores próximos de 0,2, médio para 0,5 e grande para 0,8. Para o r foi considerado um efeito pequeno para valores próximos de 0,1, médio para 0,3 e grande para 0,5.
De forma a comparar os grupos quanto às variáveis categóricas foi utilizado o teste qui‐quadrado (χ2). Como se tratavam de variáveis dicotómicas, na sua maioria, obtiveram‐se tabelas 2x2. A interpretação dos resultados dependeu do pressuposto – percentagem (%) de células com n < 5. Foram reportados os valores da correção de continuidade nas tabelas 2x2 e o Pearson Chi‐Square nas tabelas superiores a 2x2. Como medida de effect size foi utilizado o coeficiente de Phi (Φ). Valores próximos de 0,1 representam um efeito pequeno, de 0,3 um efeito médio e de 0,5 um efeito grande.
Foi utilizada a regressão logística binária para determinar possíveis fatores preditores de morte ou IC grave. Todos os preditores inseridos no modelo demonstraram relação estatisticamente significativa com o evento morte ou IC grave na análise univariada. O número de variáveis inseridas no modelo teve ainda em conta o número de eventos ocorridos.
Foram utilizadas as curvas de Kaplan‐Meyer para estimar a sobrevivência dos doentes com SCA e o log rank test para avaliar as diferenças entre os grupos.
Foi ainda avaliado se o DeF acrescenta poder preditivo adicional na estratificação de risco (morte total e morte total ou desenvolvimento de IC grave, definida como classes Killip III‐IV no internamento e/ou NYHA III‐IV no follow‐up) dos doentes com SCA com anemia versus sem anemia bem como com classes de Killip mais baixas (≤ 2) versus classes de Killip mais altas (≥3).
Os resultados foram considerados estatisticamente significativos para valores de p < 0,05 e um intervalo de confiança de 95%.
ResultadosCaracterização da amostraDurante o período de julho de 2013 a junho e 2015 foram admitidos 976 doentes com o diagnóstico de SCA na unidade coronária. Foram excluídos os doentes com doença inflamatória crónica (n = 26), patologia hepática (n = 2), DRC terminal (n = 2), tumores malignos (n = 43) e/ou a realizar suplementação de ferro ou eritropoetina (n = 3) aquando da admissão. Foram ainda excluídos os doentes sem dados analíticos relativamente aos níveis de ferro sérico, ferritina e CTFF (n = 86). Alguns doentes apresentavam mais do que um critério de exclusão, perfazendo 159 excluídos. A comparação das características basais entre os doentes incluídos no estudo e os excluídos encontra‐se sumarizada na Tabela 1.
Diferenças nas características basais entre os doentes incluídos e excluídos
| Doentes incluídos(n = 817) | Doentes excluídos(n = 159) | p | |
|---|---|---|---|
| Demográfico | |||
| Idade (anos) | 63±13 | 66±13 | 0,012 |
| Sexo Masculino (%) | 78,6 | 80,5 | 0,662 |
| FRCV (%) | |||
| Diabetes | 27,5 | 34,6 | 0,089 |
| Hipertensão arterial | 61,2 | 64,8 | 0,447 |
| Dislipidemia | 55,3 | 55,3 | 1,000 |
| Fumador ativo | 31,7 | 25,8 | 0,166 |
| Ex‐fumador | 23,3 | 26,6 | 0,426 |
| História CV (%) | |||
| EAM | 13,2 | 17,6 | 0,181 |
| Angina | 12,7 | 17,6 | 0,117 |
| AVC | 7,2 | 10,7 | 0,183 |
| Doença arterial periférica | 3,4 | 8,8 | 0,004 |
| Doença carotídea | 1,5 | 0,0 | 0,253 |
| ICP | 9,9 | 11,9 | 0,528 |
| CABG | 4,3 | 6,3 | 0,370 |
| Fibrilhação auricular | 4,7 | 6,3 | 0,501 |
| Patologia valvular | 2,9 | 7,5 | 0,003 |
| CMD | 11,0 | 13,8 | 0,558 |
| DRC | 3,7 | 10,7 | <0,001 |
| Medicação habitual (%) | |||
| AAS | 23,1 | 32,7 | 0,014 |
| Clopidogrel | 8,5 | 11,9 | 0,209 |
| Hipocoagulantes | 3,8 | 4,4 | 0,890 |
| IECA/ARA | 32,3 | 41,5 | 0,031 |
| Bloqueador‐Beta | 23,0 | 22,0 | 0,864 |
| Estatina | 36,4 | 45,3 | 0,042 |
| Bloqueador canais cálcio | 20,0 | 20,8 | 0,902 |
| Diurético | 23,4 | 32,1 | 0,027 |
| Antagonista aldosterona | 1,7 | 1,9 | 0,879 |
| Ivabradina | 1,8 | 1,3 | 0,858 |
| Nitrato | 6,0 | 6,9 | 0,793 |
| Apresentação clínica (%) | |||
| EAMcSST | 41,5 | 37,1 | 0,346 |
| EAMsSST | 53,2 | 56,0 | 0,586 |
| Angina instável | 5,3 | 6,9 | 0,475 |
Foram incluídos 817 doentes, 78,6% do sexo masculino e com uma média de 63 ± 13 anos. O FRCV mais frequente foi a HTA (61,2%), seguida pela dislipidemia (55,3%); 13,2% dos indivíduos da amostra já tinham antecedentes de EAM. A forma de apresentação da SCA mais comum foi EAMsSST (53,2%). É de realçar que as diferenças estatisticamente significativas entre os dois grupos se relacionam maioritariamente de uma forma direta com os critérios de exclusão.
Caracterização dos dois grupos da amostraO Grupo 1 era constituído por 519 indivíduos (64%) que não apresentavam DeF e o Grupo 2 por 298 indivíduos (36%) que apresentavam DeF. Relativamente aos doentes com DeF, em 165 (55%) este era absoluto e em 133 (45%) funcional. A comparação relativamente às características demográficas, a presença de FRCV, a história CV e a medicação habitual entre os dois grupos encontra‐se na Tabela 2.
Comparação das características basais entre os dois grupos
| Doentes sem défice de ferro (n = 519) | Doentes com défice de ferro (n = 298) | p | |
|---|---|---|---|
| Demográfico | |||
| Idade (anos) | 62±13 | 65±13 | 0,002 |
| Sexo masculino (%) | 86,5 | 64,8 | <0,001 |
| FRCV (%) | |||
| Diabetes | 22,0 | 37,2 | <0,001 |
| Hipertensão arterial | 57,6 | 67,4 | 0,007 |
| Dislipidemia | 54,5 | 57,1 | 0,525 |
| Fumador ativo | 35,8 | 24,5 | 0,001 |
| Ex‐fumador | 23,8 | 22,3 | 0,707 |
| História CV (%) | |||
| EAM | 11,4 | 16,4 | 0,051 |
| Angina | 11,6 | 14,8 | 0,225 |
| AVC | 5,8 | 9,7 | 0,051 |
| Doença arterial Periférica | 2,5 | 5,0 | 0,087 |
| Doença carotídea | 2,2 | 0,3 | 0,081 |
| ICP | 8,9 | 11,7 | 0,228 |
| CABG | 2,9 | 6,7 | 0,016 |
| Fibrilhação auricular | 4,0 | 5,7 | 0,362 |
| Patologia valvular | 1,7 | 5,0 | 0,082 |
| CMD | 8,7 | 15,5 | 0,051 |
| DRC | 3,3 | 4,4 | 0,547 |
| Medicação habitual (%) | |||
| AAS | 20,2 | 28,5 | 0,009 |
| Clopidogrel | 6,9 | 11,1 | 0,053 |
| Hipocoagulantes | 2,3 | 6,4 | 0,006 |
| IECA/ARA | 27,2 | 41,6 | <0,001 |
| Bloqueador‐Beta | 21,0 | 26,5 | 0,086 |
| Estatina | 35,3 | 38,6 | 0,381 |
| Bloqueador canais cálcio | 19,1 | 21,8 | 0,396 |
| Diurético | 19,7 | 30,2 | 0,001 |
| Antagonista aldosterona | 1,2 | 2,7 | 0,180 |
| Ivabradina | 1,3 | 2,7 | 0,272 |
| Nitrato | 4,6 | 8,7 | 0,028 |
A população do Grupo 1 apresentava uma média de 62 ± 13 anos, a população do Grupo 2 era significativamente mais envelhecida, apresentando uma média de 65 ± 13 anos (t(816)=‐3,141, p = 0,002 d = ‐0,230). No Grupo 1 eram mais frequentemente do sexo masculino (χ2(1, n = 817) = 51,908, p < 0,001, Φ=‐0,255).
O FRCV mais comum foi a hipertensão arterial (HTA) em ambos os grupos, 57,6% no Grupo 1 e 67,4% no 2. Observou‐se uma maior prevalência de HTA e diabetes no grupo 2 relativamente ao grupo 1 (χ2(1, n = 817) = 7,309, p = 0,007, Φ=0,097 e χ2(1, n = 817) = 21,398, p < 0,001, Φ=0,165, respetivamente). O Grupo 1 apresentou maior prevalência de fumadores ativos (χ2(1, n = 817) = 10,729, p = 0,001, Φ=‐0,117). Os restantes FRCV foram semelhantes entre os grupos.
A história CV dos doentes de ambos os grupos foi semelhante. No entanto, o Grupo 2 já tinha sido submetido a cirurgia de revascularização miocárdica (CABG) mais frequentemente (χ2(1, n = 817) = 5,842, p = 0,016, Φ=0,091). Os doentes do Grupo 2 estavam medicados mais frequentemente com ácido acetilsalicílico (AAS) (χ2(1, n = 817) = 6,836, p = 0,009, Φ=0,094), hipocoagulantes (χ2(1, n = 817) = 7,487, p = 0,006, Φ=0,102), inibidores da enzima de conversão da angiotensina/antagonistas dos recetores da angiotensina II (IECA/ARA) (χ2(1, n = 817) = 17,366, p < 0,001, Φ=0,149), diurético (χ2(1, n = 817) = 11,037, p = 0,001, Φ=0,119) e nitratos (χ2(1, n = 817) = 4,849, p = 0,028, Φ=0,082).
Apresentação clínicaA comparação dos dados relativos à apresentação clínica dos doentes de ambos os grupos encontra‐se sumarizada na Tabela 3.
Comparação da apresentação clínica entre os grupos
| Doentes sem défice de ferro (n = 519) | Doentes com défice de ferro (n = 298) | p | |
|---|---|---|---|
| Tipo de SCA (%) | |||
| EAMcSST | 43,9 | 36,9 | 0,059 |
| EAMsSST | 50,6 | 58,1 | 0,044 |
| Angina instável | 5,5 | 5,0 | 0,952 |
| Sinais vitais | |||
| TAS (mmHg) | 132 ± 27 | 130 ± 27 | 0,358 |
| TAD (mmHg) | 78 ± 16 | 77 ± 15 | 0,202 |
| FC (bpm) | 77 ± 18 | 77 ± 18 | 0,754 |
| Killip (%) | |||
| Classe II‐IV | 12,1 | 21,8 | < 0,001 |
| Classe III‐IV | 2,7 | 6,4 | 0,017 |
| Anemia (%) | 8,5 | 20,1 | < 0,001 |
| TFG < 60ml/min (%) | 17,9 | 30,2 | < 0,001 |
| P‐BNP à admissão | 2077,4 | 3878,8 | < 0,001 |
A forma mais comum de apresentação da SCA foi EAMsSST, foi mais frequente no grupo 2 (χ2(1, n = 817) = 4,061, p = 0,044, Φ=0,073)
Os dados referentes aos sinais vitais à admissão foram semelhantes entre os grupos; no entanto, os doentes do Grupo 2 apresentaram mais frequentemente classes Killip superiores (χ2(1, n = 817) = 12,685, p < 0,001, Φ=0,128), anemia e taxa de filtração glomerular (TFG) inferior a 60ml/min (χ2(1, n = 817)=22,116, p < 0,001, Φ=0,168 e χ2(1, n = 817) = 15,730, p < 0,001, Φ=0,142).
Resultados MCDTsOs dados angiográficos e ecocardiográficos estão expostos na Tabela 4.
Dados angiográficos e ecocardiográficos por grupos
| Doentes sem défice de ferro(n = 519) | Doentes com défice de ferro (n = 298) | p | |
|---|---|---|---|
| Cateterismo realizado (%) | 99,2 | 98,7 | 0,672 |
| Doença coronária (%) | |||
| Sem doença | 1,9 | 1,7 | 1,000 |
| 1 vaso | 57,5 | 47,4 | 0,008 |
| 2 vasos | 24,9 | 24,2 | 0,358 |
| 3 vasos | 16,5 | 26,6 | 0,001 |
| >2 vasos | 40,4 | 49,8 | 0,012 |
| ICP Primária (%) | 55,0 | 51,8 | 0,489 |
| Revascularização (%) | 87,7 | 81,5 | 0,022 |
| ICP | 81,5 | 73,7 | 0,012 |
| ICP 2° tempo | 10,4 | 10,9 | 0,902 |
| CABG | 8,7 | 10,5 | 0,468 |
| Ecocardiograma | |||
| FEVE (média ± desvio‐padrão) | 47,8 ± 8,8 | 42,9 ± 10,3 | < 0,001 |
| Depressão da função do VE (FEVE < 50%) (%) | 60,9 | 66,4 | 0,136 |
| Depressão moderada‐severa do VE (FEVE < 40%) (%) | 22,3 | 34,2 | < 0,001 |
| Alterações da cinética VE (%) | 87,5 | 89,6 | 0,431 |
| Função VD (%) | 3,1 | 6,4 | 0,039 |
Não se registaram diferenças significativas relativamente à realização ou não de cateterismo cardíaco nos doentes de ambos os grupos.
Verificou‐se que no Grupo 1 foi mais frequente a doença em apenas 1 vaso (χ2(1, n = 817) = 7,105, p = 0,008, Φ=‐0,097) e no Grupo 2 a doença de 3 vasos (χ2(1, n = 817) = 11,284, p = 0,001, Φ=0,122). Observou‐se ainda que o grupo 1 foi submetido mais frequentemente a procedimentos de revascularização (χ2(1, n = 817) = 5,225, p = 0,022, Φ=‐0,084).
Os doentes com DeF apresentaram mais frequentemente depressão moderada e severa da função do VE (χ2(1, n = 817) = 12,830, p < 0,001, Φ=0,130) e depressão da função do VD (χ2(1, n = 817) = 4,249, p = 0,039, Φ=0,079).
Evolução intra‐hospitalarRelativamente à terapêutica intra‐hospitalar, verificou‐se uma maior utilização de alguns fármacos no grupo 2, nomeadamente diurético (χ2(1, n = 817) = 18,288, p < 0,001, Φ=0,153), antagonistas da aldosterona (χ2(1, n = 817) = 18,097, p < 0,001, Φ=0,152) e nitratos (χ2(1, n = 817) = 4,348, p = 0,037, Φ=0,076). Não se verificaram diferenças estatisticamente significativas nos restantes fármacos.
Comparativamente, o Grupo 2 atingiu classes de Killip superiores (χ2(1, n = 817) = 19,255, p < 0,001, Φ=0,156). Não se registaram outras diferenças significativas entre os grupos na ocorrência dos restantes eventos intra‐hospitalares.
Todos os dados relativos à terapêutica e à ocorrência de eventos intra‐hospitalares estão apresentados na Tabela 5.
Comparação de evolução intra‐hospitalar entre os grupos
| Doentes sem défice de ferro (n = 519) | Doentes com défice de ferro (n = 298) | p | |
|---|---|---|---|
| Terapêutica intra‐hospitalar | |||
| HNF | 38,7 | 33,9 | 0,193 |
| HBPM | 60,3 | 66,1 | 0,116 |
| Inibidores IIb/IIIa | 8,1 | 6,4 | 0,447 |
| AAS | 99,2 | 99,3 | 1,000 |
| Clopidogrel | 98,3 | 99,7 | 0,156 |
| Bloqueador‐Beta | 89,8 | 89,6 | 1,000 |
| IECA/ARA | 92,7 | 93,6 | 0,713 |
| Estatina | 98,3 | 99,0 | 0,596 |
| Diuréticos | 20,4 | 34,2 | <0,001 |
| Antagonistas Aldosterona | 17,1 | 30,2 | <0,001 |
| Bloqueador canais cálcio | 9,2 | 10,4 | 0,679 |
| Nitratos | 14,3 | 20,1 | 0,037 |
| Inotrópicos | 3,7 | 4,4 | 0,756 |
| Eventos intra‐hospitalares | |||
| Classe Killip (%) | |||
| Classe II‐IV | 19,3 | 33,2 | < 0,001 |
| Classe III‐IV | 5,4 | 9,4 | 0,042 |
| IC (%) | 18,1 | 32,2 | < 0,001 |
| Angor (%) | 2,5 | 3,7 | 0,452 |
| Reenfarte (%) | 1,5 | 0,0 | 0,074 |
| Transfusão (%) | 1,0 | 0,7 | 0,967 |
| Morte (%) | 1,3 | 1,0 | 0,922 |
| Arritmias malignas (%) | 5,2 | 4,4 | 0,673 |
| BAV 2.° e 3.° grau (%) | 2,9 | 4,4 | 0,453 |
| Infeção respiratória (%) | 4,4 | 5,4 | 0,642 |
A informação relativa ao follow‐up dos doentes de ambos os grupos está sumarizada na Tabela 6. O follow‐up médio destes doentes foi de 738,77 dias.
Comparação dos eventos ocorridos no follow‐up entre os grupos
| Doentes sem défice de ferro (n = 519) | Doentes com défice de ferro (n = 298) | p | |
|---|---|---|---|
| Morte (%) | 6,3 | 12,6 | 0,004 |
| Causa CV | 3,2 | 4,5 | 0,424 |
| Causa não CV | 1,8 | 4,5 | 0,040 |
| Causa desconhecida | 1,4 | 3,5 | 0,086 |
| AVC (%) | 0,8 | 0,7 | 1,000 |
| Reenfarte (%) | 4,5 | 3,8 | 0,777 |
| Angor (CCS>I) (%) | 4,6 | 7,0 | 0,197 |
| IC (NYHA III‐IV) (%) | 5,3 | 10,5 | 0,011 |
| Morte total/IC grave (%) | 13,8 | 25,3 | < 0,001 |
| Readmissões hospitalares | 9,8 | 13,7 | 0,048 |
Os doentes do grupo 2 apresentaram maior taxa de eventos no follow‐up, nomeadamente maior taxa de mortalidade (χ2(1, n = 792) = 8,352, p = 0,004, Φ=0,107) e de incidência de IC com NYHA III‐IV (χ2(1, n = 792) = 6,515, p = 0,011, Φ=0,096). A taxa de readmissões hospitalares foi também superior no grupo com DeF (9,8% versus 13,7%, p = 0,048). A ocorrência de reenfarte, angor e AVC foi semelhante entre os grupos.
Avaliação do prognósticoOs fatores preditores independentes de prognóstico encontram‐se na Tabela 7. A análise dos fatores associados a morte ou desenvolvimento de IC grave encontra‐se no anexo V.
Fatores preditores independentes de morte/IC grave
| B | SE | X2 Wald | HR | 95% CI | p | |
|---|---|---|---|---|---|---|
| Idade > 60 anos | 0,233 | 0,240 | 0,942 | 1,262 | 0,79‐2,02 | 0,332 |
| TFG < 60 ml/min | 0,854 | 0,244 | 12,264 | 2,349 | 1,46‐3,79 | < 0,001 |
| Revascularização | ‐0,558 | 0,266 | 4,402 | 0,572 | 0,34‐0,96 | 0,036 |
| Défice de ferro | 0,510 | 0,207 | 6,090 | 1,666 | 1,11‐2,50 | 0,014 |
| Anemia | 0,729 | 0,261 | 7,815 | 2,072 | 1,24‐3,45 | 0,005 |
| Disfunção VE | 1,477 | 0,275 | 28,850 | 4,381 | 2,56‐7,51 | < 0,001 |
O DeF foi preditor independente da ocorrência de morte ou desenvolvimento de IC grave. Os restantes preditores independentes destes eventos foram a disfunção renal (TFG < 60ml/min), a ausência de revascularização, a anemia e a disfunção do VE.
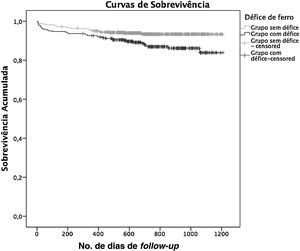
Análise da sobrevivênciaNeste estudo, foi possível realizar o seguimento de 97% dos doentes da amostra durante pelo menos um ano. Obtiveram‐se as curvas de sobrevivência de Kaplan‐Meyer dos dois grupos estudados, que se podem observar na Figura 1. Verificou‐se que houve diferença significativa entre os dois grupos estudados relativamente ao tempo de sobrevivência após o evento SCA, foi maior naqueles que não apresentavam DeF (Log‐Rank Test,p = 0,003).
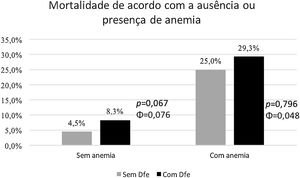
Estratificação de riscoA partir da Figura 2, apesar de se ter observado uma maior incidência de morte nos doentes com DeF independentemente da presença ou ausência de anemia, esta diferença não foi estatisticamente significativa.
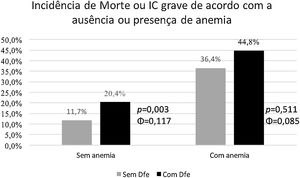
Tal como ilustrado na Figura 3, a presença de DeF permitiu estratificar adicionalmente os doentes sem anemia à admissão (χ2(1, n = 693) = 8,805, p = 0,003, Φ=0,117) relativamente à ocorrência de morte ou IC grave. No entanto, naqueles com anemia, a presença ou ausência de DeF não acrescentou poder preditivo adicional.
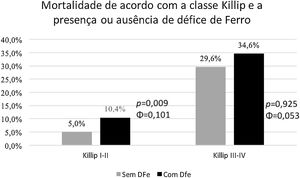
De forma semelhante, a presença de DeF permitiu estratificar adicionalmente os doentes com classes de Killip menores (≤ 2); nesses doentes, a ocorrência de morte foi mais frequente naqueles com DeF (χ2(1, n = 739) = 6,762, p = 0,009, Φ=0,101) (Figura 4). Nos doentes com classes de Killip mais altas (≥ 3), apesar de se ter verificado maior mortalidade nos doentes com DeF, essa diferença não atingiu significado estatístico.
DiscussãoO principal achado deste estudo foi que o DeF foi um fator preditor independente de morte ou IC grave numa população de doentes com SCA.
Também importante foi o facto de a presença de DeF ter permitido estratificar adicionalmente o prognóstico dos doentes sem anemia em termos de ocorrência de morte ou IC grave e aqueles com classes de Killip mais baixas (≤ 2) em termos da ocorrência de morte.
Adicionalmente, este estudo mostrou que o DeF é uma condição prevalente numa população de doentes com SCA.
Os resultados deste estudo vão de encontro ao atualmente conhecido na população de doentes com IC, em que o DeF, independentemente da anemia, se associou a maior morbilidade, número de hospitalizações, mortalidade e pior qualidade de vida2,4,5,18.
Por esse facto, as guidelines atuais de IC recomendam a realização de estudo analítico a todos os doentes com IC, de forma a diagnosticar o DeF e proceder à suplementação de ferro naqueles com fração de ejeção reduzida, preferencialmente endovenosa e com carboximaltose, independentemente da presença de anemia3,21,23.
No que concerne ao estudo do DeF na população de doentes com SCA, os dados na literatura são ainda escassos. Um dos primeiros estudos publicados nesta temática demonstrou que o DeF foi um determinante da capacidade funcional e da qualidade de vida relacionada com a saúde 30 dias após uma SCA17. Trata‐se de um estudo com poucos doentes (n = 244), com follow‐up curto (30 dias) e que se centrou na avaliação da capacidade funcional e qualidade de vida. O DeF foi preditor de capacidade funcional e qualidade de vida, mas não de morbimortalidade cardiovascular17. O presente estudo, em contrapartida, incluiu uma amostra de maiores dimensões, com avaliação de prognóstico em curto e longo prazo (seguimento mínimo de um ano) e demonstrou impacto do DeF na ocorrência de morte, tendo sido preditor independente de morte ou insuficiência cardíaca grave, a par com outros preditores amplamente conhecidos nas SCA 25,26,32–34.
No referido estudo, a prevalência de DeF foi de 46%17, ligeiramente superior à reportada no nosso estudo (36%).
Um dos motivos apontados para alta prevalência de DeF em doentes com SCA, podendo ir até 61% num estudo recente, relaciona‐se com as perdas sanguíneas durante os procedimentos invasivos e a terapêutica antitrombótica16,20,29. Já foi demonstrado que quedas de hemoglobina aumentam a mortalidade, assim como diminuições dos níveis do ferro sérico. No entanto, não foi possível demonstrar o DeF como preditor independente de morte16.
A prevalência de anemia no referido estudo foi 4,5%, inferior à constatada no nosso estudo (12,7%). Sabe‐se que a anemia é uma condição bastante comum em doentes internados, é apontada como um fator de mau prognóstico tanto em doentes com SCA como com IC, é um importante fator preditivo de morte16,21,33,35–40. A sua prevalência à admissão em doentes com SCA parece variar entre 17%‐28%, aumentando ao longo do internamento16.
Nos últimos dois anos, foram publicados alguns estudos avaliando o papel do DeF no prognóstico dos doentes internados com SCA39–42.
Um desses estudos, publicado em 2018, incluiu 836 doentes, 29,1% tinham DeF, superior nas mulheres e em pacientes com anemia41. Após um follow‐up médio de quatro anos, o DeF revelou‐se como um forte preditor de EAM não fatal e mortalidade cardiovascular nesta população de doentes. Após os resultados deste estudo e da evidência já disponível na literatura, nomeadamente da eficácia da suplementação de ferro na IC com fração de ejeção reduzida, os mesmos autores iniciaram um estudo multicêntrico randomizado controlado, o ensaio CAYAN (comprehensive management of iron deficiency in myocardial infarction)43. Neste ensaio, os doentes com EAM clinicamente relevante e DeF concomitante são randomizados para receber carboximaltose férrica ou placebo (solução salina). Todos os pacientes são submetidos a ressonância magnética cardíaca na baseline e follow‐up para avaliar o endpoint primário (variação da fração de ejeção ventricular esquerda na baseline e no quarto mês de follow‐up). De referir que os estudos referidos avaliaram o DeF à data da ocorrência do evento como marco para definição dos grupos com e sem DeF e avaliação dos respetivos prognósticos. Tal como no presente estudo, não foi feita análise da suplementação de ferro no follow‐up e da sua eventual correção, bem como da sua influência no prognóstico em longo prazo, pelo que os resultados deste ensaio poderão vir a ser importantes na mudança de atuação relativamente aos doentes com SCA e défice de ferro.
Num outro estudo publicado em 2019, que incluiu 420 doentes com EAMcSST, avaliou‐se a associação de DeF com a mortalidade intra‐hospitalar e classe Killip 3 e 4. Neste estudo, obteve‐se um resultado paradoxal, em que os doentes com DeF tiveram um melhor prognóstico intra‐hospitalar42.
No presente estudo, a anemia também constituiu um fator de mau prognóstico. No sentido de avaliar se a relação do DeF com o prognóstico era independente da anemia, além da análise de regressão logística já descrita previamente, dividiu‐se a amostra em dois grupos (com anemia e sem anemia à admissão) e comparou‐se a incidência de morte em indivíduos com e sem DeF. Verificou‐se que, independentemente da presença de anemia, os doentes com DeF tinham maior taxa de mortalidade do que os doentes sem défice, mas sem diferenças estatisticamente significativas, resultado possivelmente relacionado com o baixo número de mortes ocorridas na amostra. No entanto, na estratificação do risco de morte ou desenvolvimento de IC grave, o grupo sem anemia mas com DeF apresentou maior taxa de eventos do que os sem DeF. Uma possível explicação para este resultado poderá prender‐se com o facto de o ferro não ter importância apenas ao nível da hematopoiese, mas também condicionar o metabolismo celular devido à sua extensa atuação nas mais variadas reações enzimáticas, na indução de stress oxidativo, podendo mesmo provocar alterações estruturais nos cardiomiócitos, afetando o remodeling ventricular e piorando a função do VE, o que, consequentemente, conduz a pior prognóstico4,8,11,14,15. Este resultado vai de encontro ao já recomendado pelas guidelines de IC, em realizar suplementação de ferro aos doentes com DeF mesmo na ausência de anemia. Na estratificação de risco de morte ou IC grave nos doentes com anemia, verificou‐se maior ocorrência de eventos naqueles com DeF, apesar de não ser estatisticamente significativo.
De forma semelhante, no sentido de estudar o papel do DeF na IC das SCA, dividiu‐se a amostra em dois grupos, os doentes com Classe de Killip I‐II e os com Classe de Killip III‐IV. Foi possível observar que naqueles com Classe de Killip I‐II, o DeF permitiu estratificá‐los adicionalmente relativamente ao risco de morte, com maior taxa de mortalidade naqueles com DeF. Uma das possíveis explicações para este resultado poderá prender‐se com a alterações da resposta celular imunológica desencadeadas pelo DeF, para além dos mecanismos de desarranjo do metabolismo energético já descritos1,3,4,8,11. Este resultado salienta a importância no DeF mesmo na ausência de IC ou IC ligeira na população de doentes com SCA. Nos doentes com Classe de Killip III‐IV, apesar de se verificar uma maior mortalidade naqueles com DeF, este resultado não foi estatisticamente significativo, o que poderá dever‐se ao baixo número de doentes incluído neste grupo e/ou ao baixo número de eventos ocorridos.
Ao contrário das guidelines de IC, as de SCA não recomendam ainda o estudo da cinética do ferro a todos os doentes com esta patologia25,26. Tal facto poderá estar relacionado com a necessidade de estudos clínicos publicados nesta área.
LimitaçõesTrata‐se de um estudo unicêntrico e retrospetivo com todas as limitações inerentes conhecidas. Adicionalmente, foi efetuado apenas um doseamento dos parâmetros da cinética do ferro, impossibilitando a avaliação da evolução destes no longo do tempo. Além disso, não foi feita avaliação da terapêutica no follow‐up, nomeadamente da eventual suplementação de ferro. Por último, alguns doentes foram excluídos pela ausência de parâmetros da cinética ferro o que pode ser encarado como um viés do estudo.
ConclusãoEste estudo mostrou que o DeF é uma condição prevalente numa população de doentes com SCA e que, nesta população, foi um fator preditor independente de morte ou IC grave. Além disso, o DeF permitiu estratificar adicionalmente o prognóstico dos doentes sem anemia à admissão em termos de ocorrência de morte ou IC grave e daqueles com classes de Killip mais baixas (≤ 2) em termos da ocorrência de morte.
Estes resultados poderão vir a ter impacto na prática clínica, sobretudo se estudos adicionais provarem a melhoria do prognóstico destes doentes após a suplementação com ferro.
Conflitos de interesseO autor declara não haver conflitos de interesse.