As anomalias congénitas das artérias coronárias são alterações da sua origem, trajeto ou estrutura e a sua incidência varia entre 0,2 e 5,6%. Apesar de a maioria ser assintomática, são a segunda causa morte súbita de origem cardíaca em jovens atletas.
O objetivo deste trabalho é salientar as principais anomalias com repercussões hemodinâmicas, nomeadamente as anomalias da origem das artérias coronárias na aorta e as anomalias em que a artéria coronária esquerda tem origem na artéria pulmonar.
As anomalias da origem das artérias coronárias na aorta correspondem a 14‐17% de todas as mortes súbitas de causa cardíaca, que ocorrem inesperadamente em crianças saudáveis ou jovens atletas durante ou imediatamente após o exercício físico. O mecanismo responsável pela compressão/oclusão da artéria coronária com origem no seio coronário oposto ainda não é claro e existem vários mecanismos propostos. A apresentação clínica desses doentes é bastante variável e o exame físico é na maioria das vezes normal. O ecocardiograma transtorácico é o exame mais usado para o diagnóstico. A abordagem, o tratamento e o seguimento desses doentes é ainda um tema controverso.
A origem anómala da artéria coronária esquerda na artéria pulmonar é ainda mais rara e a maioria dos doentes morre no primeiro ano de vida, se não for feita correção cirúrgica. O ecocardiograma é também o método de eleição para a sua confirmação. O diagnóstico dessa anomalia numa criança, gravemente doente, é indicação cirúrgica de urgência.
Pelas alterações hemodinâmicas que acarretam, o seu diagnóstico e tratamento precoce são importantes.
Congenital coronary artery anomalies are modifications of their origin, course or structure and its incidence varies between 0,2 and 5,6% of the general population. Although the majority is asymptomatic, they are the second leading cause of sudden cardiac death in young athletes.
The aim of this study is to highlight the main anomalies with hemodynamic significance, including the anomalous origin of a coronary artery from the opposite sinus and anomalous origin of the left coronary artery from pulmonary artery.
The anomalous aortic origin of a coronary artery from the opposite sinus accounts for 14‐16% of all cardiac deaths, that unexpectedly occur in healthy children or young athletes during or immediately after exercise. The mechanism responsible for the compression/occlusion of the coronary artery originating from the opposite sinus is still unclear and there are several proposed mechanisms. The clinical presentation of these patients is variable and physical examination is normal in most individuals. Transthoracic echocardiogram is the diagnostic test most commonly used. Treatment and management are controversial topic.
The anomalous origin of the left coronary artery from pulmonary artery is a very rare condition and without surgery, most infants die within the first 12 months of life. The echocardiogram is also the method of choice for diagnostic confirmation. The diagnosis of this congenital anomaly in an infant, usually seriously ill, is an indication for urgent surgery.
Because these anomalies produce hemodynamic changes, it is important an early diagnosis and treatment.
As anomalias congénitas das artérias coronárias (ACACs) foram descritas pela primeira vez há dois milénios, por Galen e Vesalius1, e são alterações da sua origem, estrutura e trajeto2.
De facto, esse tema tem ganho maior notoriedade devido à associação com morte súbita3, apesar de a maioria das ACACs ser benigna, sem implicações hemodinâmicas ou no prognóstico4.
As doenças das artérias coronárias são das principais causas de morbilidade e mortalidade em todo o mundo. Dentro dessas, as ACACs, apesar de menos prevalentes, são uma potencial fonte de arritmias malignas, isquemia e disfunção do miocárdio3. Em jovens atletas, as ACACs são consideradas a segunda causa de morte súbita cardíaca (em 12% das mortes), geralmente precipitada por exercício físico vigoroso4,5. A morte súbita de causa cardíaca pode ser definida como uma morte inesperada de origem cardíaca, geralmente em menos de uma hora após o início dos sintomas, num indivíduo sem patologia prévia fatal conhecida4. Segundo um estudo a partir do registo da Minneapolis Heart Institute Foundation, as duas causas mais frequentes de morte súbita foram a cardiomiopatia hipertrófica em 36% e as ACACs em 17%6.
Apesar de a maioria das ACACs ser assintomática e sem repercussão hemodinâmica, existem ACACs com significado clínico7, classificadas em dois subgrupos: anomalias das artérias coronárias com origem no seio coronário oposto (origem da coronária esquerda no seio coronário direito e coronária direita com origem no seio coronário esquerdo) e anomalias em que a artéria coronária esquerda tem origem na artéria pulmonar (ACEOAP)3. Essas anomalias estão associadas à morte súbita. Contudo, existem outras ACACs menos comuns, mas que também podem estar relacionadas com a morte súbita cardíaca, nomeadamente a presença de uma artéria coronária única com trajeto interarterial, atrésia do óstio coronário ou fístulas arteriais4,6,8.
Na presença de ACACs, a morte súbita está relacionada com a isquemia do miocárdio, resulta em arritmias ventriculares malignas. As exigências fisiológicas da atividade física dependem do tipo de exercício. Os dois tipos de exercício, isotónico ou isométrico, envolvem o uso de grandes massas musculares que aumentam o retorno venoso, o volume telediastólico do ventrículo esquerdo e juntamente com a estimulação do sistema simpático adrenérgico implicam aumento da frequência cardíaca, pressão arterial, do débito cardíaco e da contractilidade do miocárdio. Essas respostas têm como objetivo aumentar o fornecimento de oxigénio no miocárdio, com aumento do fluxo sanguíneo, que perante essas anomalias está comprometido6,9,10.
Essas anomalias são mais comuns em indivíduos com doenças cardíacas congénitas, nomeadamente a tetralogia de Fallot, a transposição das grandes artérias e algumas formas de atrésia pulmonar, comparativamente àqueles com o coração estruturalmente normal. Os sintomas normalmente são mais precoces, assim como o diagnóstico. Essa associação afeta a abordagem e o prognóstico da doença de base7,11.
A verdadeira incidência das ACACs na população geral continua por esclarecer, varia entre 0,2% e 5,6%. Essa diferença depende do método (autópsia versus angiografia), dos critérios de diagnóstico e da população estudada4,12,13. Não são conhecidas diferenças na incidência entre etnias ou géneros2.
As ACACs são frequentemente identificadas apenas na autópsia e o seu diagnóstico é um desafio que exige um alto índice de suspeição clínica, pois a maioria dos indivíduos afetados é assintomática e tem um exame físico normal. Os sintomas, tais como dor torácica, dispneia ou síncope, ocorrem em apenas 18% a 30% dos doentes 4,14,15.
O presente trabalho tem por objetivo salientar as principais ACACs primárias que apresentam repercussões hemodinâmicas, nomeadamente as anomalias das artérias coronárias com origem no seio coronário oposto e as anomalias em que a artéria coronária esquerda tem origem na artéria pulmonar.
Anatomia e embriologia das artérias coronáriasO correto estudo das ACACs implica uma breve revisão do desenvolvimento das artérias coronárias e da sua anatomia.
Definir a normalidade na anatomia das artérias coronárias é um desafio. Angelini et al. classificaram como normal qualquer anatomia presente em mais de 1% da população geral, inclusive inúmeras variantes anatómicas. Assim, por definição, as ACACs ocorrem em menos de 1% da população4,5,16.
Habitualmente, a artéria coronária esquerda surge do seio coronário esquerdo, adquire um trajeto para a esquerda e posterior, relativamente ao tronco da artéria pulmonar, bifurca‐se em duas artérias: a artéria descendente anterior, situada no sulco interventricular anterior, responsável pela irrigação sanguínea dos dois terços anteriores da região basal do septo e da sua região média e apical, e a artéria circunflexa, que se encontra no sulco auriculoventricular esquerdo, irriga a parede do ventrículo esquerdo2,17.
Por outro lado, a artéria coronária direita originada no seio coronário direito é responsável pela irrigação sanguínea da parede ventricular direita e apresenta um trajeto anterior e para a direita, entre a aurícula direita e a artéria pulmonar, situada no sulco auriculoventricular. Durante esse percurso, dá origem a diversos ramos2,17,18. Em relação a variantes do normal, podemos ainda referir que a artéria descendente posterior, que irriga a parede inferior e o terço inferior do septo, pode ter origem na artéria coronária direita (dominância direita, a maioria), artéria coronária esquerda (dominância esquerda) ou ambas (codominância)16. Não há dado na literatura que permita inferir que a dominância tenha implicações na sobrevida do indivíduo com ACACs. No entanto, sabe‐se que num sistema dominante esquerdo a artéria coronária direita não contribui para a perfusão do ventrículo esquerdo, o que pode ter implicações em caso de evento.
Durante as fases iniciais do desenvolvimento fetal humano, os sinusoides vasculares desenvolvem‐se no interior do miocárdio embrionário. Quando esse se torna compacto, os sinusóides desaparecem e surge uma rede de veias, artérias e capilares que comunicam com outros vasos do mediastino, aproximadamente aos 32 dias de gestação. Os vasos coronários primitivos aparecem por volta da sétima semana de gestação, após a formação da aorta a partir da divisão do truncus arteriosus. À medida que a rede arterial coronária se desenvolve, surgem os botões endoteliais, na base do truncus arteriosus, que posteriormente se juntam com rede arterial coronária, que se desenvolve a partir dos sinusóides, estabelecem o sistema arterial coronário definitivo. A involução anómala, a posição dos botões endoteliais ou a septação do truncus arteriosus podem levar ao desenvolvimento das anomalias na origem das artérias coronárias19,20.
Com essa embriologia complexa, é de esperar que alterações no desenvolvimento possam resultar em anomalias congénitas19.
ClassificaçãoA classificação das ACACs é um tema controverso e existem vários modelos propostos.
A primeira data de 1969 e foi proposta por Ogden21, foram ordenadas em três categorias: variações minor, anomalias coronárias major e anomalias coronárias secundárias. Contudo, esse sistema não enfatiza a importância clínica de certas alterações5,22,.
A classificação proposta por Angelini23, inicialmente em 1989 e posteriormente atualizada, é atualmente uma das mais usadas e divide as ACACs em: a) anomalias da origem e do trajeto, b) anomalias da anatomia intrínseca da artéria; c) anomalias do leito coronário terminal e d) anomalias dos vasos anastomóticos. O princípio básico desse sistema é que a denominação de uma artéria é determinada pelo território que irriga, e não com base na sua origem ou trajeto inicial2,8. Segundo Angelini, são consideradas normais as seguintes características: a presença de dois a quatro óstios, nos seios coronários direito e esquerdo; um ângulo entre 45˚ a 90˚ da coronária no nível proximal com a parede da aorta; a presença de um tronco comum, localizado à esquerda, que dá origem à artéria descendente anterior e à artéria circunflexa; um segmento médio subepicárdico, com ramos adequados ao miocárdio dependente e a finalização de todo o sistema numa rede de capilares2,5,8.
Apesar de a classificação anterior ser detalhada, abrangente e compreensível, em 2000 Dodge‐Khatami et al. introduziram um novo sistema de nomenclatura e classificação, como parte integrante do International Congenital Heart Surgery Nomenclature and Database Project da European Association of Cardio‐Thoracic Surgery e Society of Thoracic Surgeons. Esse sistema foi adotado para a classificação de diagnósticos e procedimentos nas bases de dados de cirurgias cardíacas congénitas, com base em vários níveis de hierarquia. Essa classificação tem sido usada para registar as anomalias da artéria coronária com origem na aorta, com o objetivo de desenvolver orientações para o seu tratamento e seguimento5,12.
Em 2003, surgiu uma nova classificação, proposta por Rigatelli et al., com o objetivo de ser mais prática e simples, padronizar os critérios de diagnóstico e os grupos de ACAC em sete categorias: hipoplasia/atrésia, artéria coronária única, fístulas, origem em outras artérias, origem no seio coronário errado, separação (origens separadas da artéria descendente anterior e circunflexa) e trajeto intramiocárdico24. Essa classificação é mais simplista, porém, em contraponto, a classificação de Angelini permite estabelecer a relação entre a clínica e a anomalia, por se referir ao território irrigado.
Artéria coronária com origem anómala na aorta (ACOAA)A ACOAA é uma anomalia congénita da origem ou trajeto da artéria coronária com origem na aorta25, cuja incidência varia entre 0,28% e 1,74%, em estudos feitos com angiografia coronária26. Dentro desse grupo, fazem parte as anomalias da artéria coronária com origem no seio coronário oposto, alteração que representa uma das principais causas de morte súbita25.
A prevalência das ACOAA para a origem da coronária direita com origem no seio coronário esquerdo varia entre 0,06% e 0,9%. No caso da origem da coronária esquerda no seio coronário direito, a prevalência é menor (de 0,025% a 0,15%)1,25.
Em 1962, foi descrita uma anomalia da artéria coronária esquerda com origem no seio coronário direito, num rapaz saudável encontrado morto após uma corrida de corta‐mato. Posteriormente, Cheitlin et al., em 1974, demonstraram que vários doentes autopsiados, com anomalias da artéria coronária com origem no seio coronário oposto, tiveram morte súbita1.
A incidência anual de morte súbita cardíaca entre os jovens atletas com ACOAA com origem no seio coronário oposto é entre 1:43.800 e 1:200.000, corresponde a 14‐17% de todas as mortes de causa cardíaca. A maior parte das mortes associadas a essa alteração ocorre inesperadamente em crianças saudáveis ou jovens atletas durante ou imediatamente após o exercício físico e estão mais associadas a desportos como basquetebol, futebol, natação e atletismo25,27.
A maioria desses eventos ocorre entre os 10 e 30 anos25. A morte súbita cardíaca em indivíduos mais velhos é menos comum, está normalmente associada a fenómenos ateroscleróticos. Esse menor risco é provavelmente explicado pela menor participação em desportos de alta intensidade13.
Devido à distribuição etária da sua incidência, essa causa de morte tem grande impacto social, pelo grande número de anos de vida potencialmente perdidos28.
Apesar de a anomalia da origem da coronária direita no seio coronário esquerdo ser aproximadamente seis vezes mais prevalente do que a anomalia da origem da coronária esquerda, essa parece ser responsável por até 85% dos casos de morte súbita cardíaca relacionados com ACOAA, o que a torna uma anomalia mais letal13,25. A oclusão da artéria coronária esquerda resulta numa maciça isquemia anterolateral e septal, seguida por taquicardia/fibrilhação ventricular ou enfarte extenso do miocárdio e choque cardiogénico. Se a oclusão for na região proximal da artéria coronária direita, o enfarte resultante é da região inferior do miocárdio, o que geralmente não é fatal6.
A artéria coronária com origem no seio coronário contralateral apresenta cinco potenciais trajetos: (1) pré‐pulmonar: que normalmente não apresenta consequências hemodinâmicas, frequentemente envolve a artéria coronária esquerda e é particularmente comum na tetralogia de Fallot; (2) retroaórtico: com curso posterior à raiz da aorta, variante que também não apresenta significado hemodinâmico e envolve frequentemente a artéria coronária direita; (3) interarterial: situado entre a aorta e a artéria pulmonar e que está associado a um pior prognóstico; (4) transeptal: com curso subpulmonar, em que a artéria mais envolvida é a coronária esquerda e (5) retrocardíaco: no sulco interventricular auriculoventricular posterior16,29.
Brothers et al.14 apresentaram a primeira série de casos de famílias com ACOAA com curso interarterial, na população pediátrica, levantaram a questão de uma possível ligação genética. De facto, existem várias causas genéticas de morte súbita em crianças, para o qual está recomendado o rastreio para identificação de outros parentes. Ainda não foram identificadas alterações genéticas responsáveis pelas ACACs. No entanto, pela possibilidade de associação familiar demonstrada, o rastreio com recurso a ecocardiograma nos parentes diretos pode ser importante na prevenção de morte súbita14.
Apesar da evidente associação entre ACOAA e a morte súbita, ainda nenhum estudo demonstrou o mecanismo que explique essa relação. Acredita‐se que a coronária está sujeita a compressão/oclusão durante o exercício físico, leva à isquemia do miocárdio e taquicardia ou fibrilhação ventricular13,25. O mecanismo responsável por essa compressão/oclusão ainda não é claro, existem várias hipóteses propostas:
Curso interarterialA artéria coronária com origem no seio coronário oposto pode apresentar um trajeto entre a aorta e a artéria pulmonar, o que pode levar a artéria anómala a ser comprimida entre esses dois grandes vasos durante o exercício vigoroso. Contudo, estudos com ecografia intravascular mostraram que o estreitamento do segmento proximal da coronária anómala acontece mesmo quando a artéria pulmonar se afasta durante o ciclo cardíaco25. Adicionalmente, a baixa pressão verificada na artéria pulmonar, quando comparada com a pressão da artéria coronária, mesmo durante o esforço físico, parece também não justificar essa compressão13,25.
Curso intramuralMuitos doentes com ACOAA apresentam um comprimento variável do segmento proximal da artéria coronária, com um trajeto no interior da parede aórtica, antes da entrada no mediastino25. Desse modo, é plausível que a expansão da aorta durante o exercício físico possa comprimir essa porção intramural da artéria coronária13,25. Esse comprimento segmentar é uma medida de gravidade2.
Vários estudos de Angelini2 demonstraram a importância dessa alteração, descreveram vários mecanismos de estenose. Com recurso à ecografia intravascular verificou‐se que a circunferência do segmento intramural da artéria, com origem ectópica, é 20%‐70% menor do que o segmento distal extramural da mesma artéria coronária2,25. Essa discrepância foi quantificada num índice de hipoplasia. As artérias que apresentam congenitamente esse trajeto na parede da aorta provavelmente não crescem normalmente, antes ou depois do nascimento2. A secção transversal do segmento intramural não é circular, mas ovoide. A compressão lateral de uma artéria, com essas características, resulta numa menor área, relativamente à forma circular com a mesma circunferência2,25, e essa alteração pode ser avaliada pela razão de assimetria. Adicionalmente, Angelini2 demonstrou que esse segmento com menor diâmetro é progressivamente mais comprimido durante a sístole e que esse comportamento estaria relacionado com modificações no volume sistólico (e consequentemente na pulsatilidade da aorta ascendente) e com taquicardia – através da simulação de exercício físico vigoroso com teste de stress com dobutamina ou sobrecarga hídrica2,25.
Provavelmente com a idade, o espessamento e o aumento da rigidez da parede da aorta diminuem a sua distensibilidade, diminuem o risco de morte súbita na população mais velha6.
Anomalias no óstioDevido ao trajeto oblíquo, na região proximal, que a artéria coronária anómala apresenta, o óstio coronário pode ser de tipo fenda, em vez de circular. Dessa forma, pode colapsar, exercer efeito de válvula, pela expansão aórtica durante a sístole e durante o exercício, compromete a irrigação sanguínea. Adicionalmente, não é raro existir uma estenose no óstio coronário. Essas alterações podem limitar o aumento do fluxo sanguíneo, inerente ao exercício físico6,13,25.
Origem em ângulo agudoHabitualmente perpendicular no indivíduo com anatomia normal, a artéria coronária anómala pode iniciar‐se num ângulo agudo a partir da aorta, o que pode alterar o fluxo sanguíneo13,26. Essa origem oblíqua pode resultar em lesão da íntima e espasmo coronário, desencadeado pela estimulação adrenérgica simpática, resultante da atividade física6. Pelas alterações de fluxo, essa anomalia pode tornar a artéria mais susceptível a aterosclerose16.
A apresentação clínica dos doentes com ACOAAs é bastante variável, pode manifestar‐se como dor torácica inespecífica, palpitações, dispneia ou síncope; mais relacionadas com o esforço físico. Contudo, o indivíduo pode ser assintomático e a primeira apresentação ser a morte súbita1,25,30.. Um estudo mostrou que cerca de metade dos doentes que apresentavam esta anomalia e morreram subitamente após exercício físico era assintomática13.
O exame físico na maioria das vezes é normal, a menos que exista uma lesão cardíaca estrutural associada. Assim, o diagnóstico desses doentes constitui um desafio25. A maioria das ACOAAs é descoberta incidentalmente, durante a angiografia coronária, feita em doentes com doença isquémica ou doença valvular26.
O eletrocardiograma (ECG) ou a prova de esforço podem apresentar alterações sugestivas de isquemia (ondas Q ou alterações no segmento ST) ou arritmia cardíacas, mas na maior parte das vezes são normais. Essas alterações, especialmente em crianças ou jovens, podem levantar a suspeita de anomalias e ser o ponto de partida para outros meios complementares de diagnóstico29,31.
A imagiologia apresenta um importante papel na deteção, categorização e estratificação do risco dos doentes com essas ACOAAs15.
O papel da cintigrafia de perfusão miocárdica não está totalmente esclarecido. Vários estudos documentaram que apenas uma pequena percentagem de indivíduos, intervencionada cirurgicamente, apresentava esse exame com alterações25.
O ecocardiograma transtorácico é o método de imagem mais usado para esse diagnóstico. É um excelente método, amplamente disponível, de baixo custo, não invasivo e que não expõe o indivíduo a radiação ionizante e por esses motivos deve ser preferido. É capaz de identificar artérias coronárias anómalas em indivíduos jovens, pois a capacidade de observar a origem e os segmentos proximais das artérias coronárias é muito alta. A identificação da origem das artérias coronárias deve fazer parte da rotina de qualquer exame ecocardiográfico6,15. No entanto, vários estudos demonstraram uma sensibilidade variável, justificada pela sua dependência do operador, da idade do doente e da anomalia em causa31,32. O ecocardiograma transesofágico pode também mostrar a origem de ambas as artérias coronárias6,26.
A coronariografia convencional já foi considerada o gold standard no diagnóstico das ACACs. No entanto, é um método invasivo e que usa radiação ionizante. Com a evolução das técnicas de imagem, especialmente com a ressonância magnética e a tomografia computorizada, foi possível a avaliação tridimensional da origem e do trajeto das artérias coronárias31,33.
A angiografia por tomografia computorizada (angio‐TC) ou angiografia por ressonância magnética (angio‐RM) são métodos não invasivos, muitas vezes usados para confirmar o diagnóstico dessas anomalias25.
A angio‐RM é capaz de fornecer informações sobre a perfusão e função miocárdica, viabilidade e fluxo arterial sem recorrer à radiação ionizante. Contudo, em crianças é muitas vezes necessário recorrer à sedação e, mais importante ainda, não apresenta resolução espacial necessária e contraste adequados para avaliar o óstio e o curso proximal da artéria coronária, de modo a distinguir curso intramural de interarterial. Também não permite obter informações sobre as alterações dinâmicas do lúmen coronário durante o ciclo cardíaco25,34.
Os recentes avanços da angio‐TC cardíaca têm permitido a obtenção de mais informação com essa técnica, assim como o uso de doses menores de radiação ionizante. Com a angio‐TC é possível definir com precisão a localização, forma e angulação da origem de cada artéria coronária, o seu trajeto e a sua relação com os grandes vasos. A utilidade desse meio auxiliar em definir a anatomia das artérias coronárias tem sido reportada em diversos estudos, tal como evidenciou Amado J et al.32b num estudo retrospetivo que comprovou a utilidade deste exame para deteção de ACACs9,34,35.
Um protocolo de diagnóstico proposto por Barriales‐Villa26, para doentes com menos de 35 anos com suspeita dessas anomalias, define que na abordagem inicial deve ser feito ecocardiograma transtorácico, que permite a identificação do óstio, mas tem limitações no nível do trajeto das coronárias. Se persistir a dúvida ou for impossível a observação da origem e do trajeto das artérias coronárias, deve‐se optar por um ecocardiograma transesofágico ou angio‐TC26.
A 36ª Conferência de Bethesda, que deu origem a uma publicação em abril de 2005, recomenda que as anomalias das artérias coronárias devam ser consideradas em atletas com síncope associada ao exercício ou arritmias ventriculares sintomáticas e investigadas, deve‐se recorrer a meios auxiliares como a ecocardiografia, ressonância magnética ou a tomografia computorizada. A angiografia coronária está indicada se os estudos anteriores falharem no diagnóstico36.
A abordagem terapêutica é um dos aspetos mais controversos, uma vez que não existem orientações oficiais26,27. As linhas de orientação relacionadas com a doença cardíaca congénita da Sociedade Europeia de Cardiologia são omissas quanto à abordagem terapêutica desses doentes37.
Em indivíduos com menos de 30 anos, com evidência de isquemia ou arritmias ventriculares e com sintomas mais graves como a síncope, é consensual que deve ser oferecida a opção cirúrgica. Contudo, a gestão dos outros doentes permanece controversa, nomeadamente dos indivíduos assintomáticos com idade inferior a 30 anos sem isquemia documentada e doentes sintomáticos mas sem isquemia documentada, em que os sintomas não revelam com fiabilidade a existência de isquemia1,6. É importante considerar que a morte súbita é um evento raro em indivíduos com idade superior a 30‐35 anos e que nos mais velhos, assintomáticos, o risco de complicações decorrentes da cirurgia supera o benefício terapêutico e a cirurgia deve ser evitada1,27.
No que concerne ao exercício físico, as recomendações sugerem a restrição da prática de «desporto de competição». Essa definição é vaga e o seu cumprimento pelas crianças e jovens pode ser um problema. Além disso, a possibilidade de morte súbita com exercícios mínimos não é salvaguardada. Por outro lado, em crianças e jovens ativos, o benefício pode ser menor do que o risco, pois a atividade física regular constitui uma componente importante do crescimento e desenvolvimento, com benefícios psicológicos e na saúde físico bem conhecidos. Vários autores sugerem que a atividade curricular da disciplina de educação física pode ser feita desde que não envolva exercício extenuante1,25.
Uma atitude de vigilância ou a terapêutica médica com bloqueadores beta têm sido propostas, com aparente sucesso. No entanto, os estudos que envolvem essa abordagem têm seguimentos inferiores a dois anos. Há registo de apenas um estudo38 com seguimento de cinco anos, em que foram usados bloqueadores beta em indivíduos com média de 55 anos e com a artéria coronária direita com origem no seio coronário oposto, sem aterosclerose e não submetidos a cirurgia em que não foram reportados casos de morte súbita. Adicionalmente, esses fármacos são usados em outras condições que predispõem a morte súbita, como a cardiomiopatia hipertrófica ou síndrome congénita do QT longo. Por isso, a decisão de instituir terapêutica preventiva com bloqueadores beta deve ser cuidadosamente avaliada1,39.
O tratamento cirúrgico inclui várias técnicas: bypass coronário, reimplantação do vaso anómalo no seio coronário correto, ostioplastia ou translocação da artéria pulmonar para reduzir o risco de compressão do vaso anómalo (se esse apresentar um trajeto interarterial). Recentemente, o unroofing do vaso anómalo no seu segmento intramural tornou‐se das opções mais usadas4,25. Contudo essa última técnica apresenta um risco de atingimento da válvula aórtica com posterior insuficiência1.
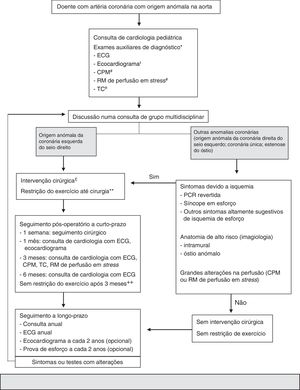
Devido às controvérsias em torno desse tema, Mery et al.25 criaram um algoritmo clínico (figura 1), baseado na evidência da literatura existente à data, e que é uma tentativa para a orientação inicial desses doentes, é passível de revisão consoante a evidência25.
Mery et al. criaram um programa multidisciplinar em 2012, para a criação de um algoritmo clínico.
*Estudos adicionais podem ser pedidos, dependem da avaliação clínica.
¿Ecocardiograma feito no exterior não precisa de ser repetido se o estudo foi adequado.
# Esses exames não são necessários em doentes com paragem cardiorrespiratória revertida. A RM depende da idade e colaboração do doente.
¿¿ TC feita no exterior pode ser usada se as imagens estiverem disponíveis e o estudo fornecer toda a informação necessária para a tomada de decisão.
£Unroffing se segmento intramural significativo, criação de um novo óstio ou translocação se segmento intramural atrás da comissura, translocação da coronária ou ostioplastia se não existir segmento intramural. Em doentes entre 10‐35 anos, os outros caso a caso.
**Restrição na participação em desportos competitivos ou exercícios com componente dinâmica moderada ou alta (mais de > 40% de uso de oxigénio máximo; exemplo: natação, futebol, basquetebol).
++ indivíduos no pós‐operatório são autorizados a praticar qualquer exercício ou desporto competitivo com base na avaliação ao 3°mês, que inclui resultados da CPM, RM de perfusão em stress ou TC.
ACOAA: artéria coronária com origem anómala na aorta, CPM: cintigrafia de perfusão miocárdica, ECG: eletrocardiograma, PCR: paragem cardiorrespiratória revertida, RM: ressonância magnética, TC: tomografia computorizada.
Adaptado de 2015 Texas Children's Hospital. Copyright© 2015 Texas Children's Hospital. All rights reserved.
Esse algoritmo preconiza que todos os doentes com ACOAA sejam observados por dois cardiologistas e façam um conjunto de exames padronizados: ecocardiograma, angio‐TC e cintigrafia de perfusão miocárdica. Posteriormente, todos os doentes são discutidos num programa multidisciplinar dedicado às ACAC, de modo a decidir a melhor estratégia a seguir. Aos indivíduos com artéria coronária esquerda com origem no seio coronário oposto é proposta intervenção cirúrgica. Aos que apresentem outras anomalias, a intervenção cirúrgica é proposta se apresentarem sintomas ou se os exames auxiliares de diagnóstico revelarem alterações de alto risco, tais como um longo trajeto intramural da coronária anómala ou alterações dinâmicas do óstio com o ciclo cardíaco. Todos os doentes são acompanhados clinicamente em intervalos definidos. A restrição de exercício físico dinâmico é aconselhada apenas aos doentes que aguardam intervenção cirúrgica ou que a recusaram. Para os doentes submetidos a cirurgia, a restrição da atividade física cessa três meses após a intervenção, se o doente estiver assintomático e se os exames auxiliares não demonstrarem alterações.
Por fim, é importante realçar que qualquer explicação para a morte súbita relacionada com as ACOAAs deve ter em conta certos factos, que têm sido bem documentados: (a) a morte súbita está frequentemente associada com ou imediatamente após o exercício físico vigoroso; (b) os indivíduos que morrem subitamente, na maioria das vezes, fazem o mesmo ou maior nível de atividade física sem qualquer sintoma, o que sugere que esse mecanismo de obstrução/compressão é intermitente e imprevisível; (c) a morte súbita associada a essas anomalias é rara após os 30 anos; (d) o ECG, prova de esforço e ecocardiograma antes ou depois de um episódio de paragem cardiorrespiratória súbita revertida são normalmente negativos. Dessa forma, é provável que nesses doentes a isquemia do miocárdio não seja provocada com a reprodução do exercício que precipitou o evento; (e) seja qual for o mecanismo responsável pela oclusão/compressão da artéria anómala, é provável que envolva a porção mais proximal da artéria. Nos doentes que sobrevivem ao episódio de isquemia do miocárdio, o território irrigado por essa artéria torna‐se um substrato para arritmias ventriculares malignas6.
Artéria coronária esquerda com origem na artéria pulmonarApesar de ser uma anomalia congénita mais rara que a ACOAA, tem um elevado significado clínico. Também conhecida por síndrome de Bland‐White‐Garland, nome dos autores que fizeram a primeira descrição clínica, em 193340, após a autópsia de um lactente de três meses. Esse apresentava dificuldade na alimentação, cardiomegalia e evidência de lesão no ventrículo esquerdo no ECG. No entanto, a descrição anatómica dessa anomalia foi inicialmente feita por Brooks41, em 1883. A grande maioria morre no primeiro ano de vida, se não for feita cirurgia, o que acontece até 90% das crianças. Desse modo, é pouco frequente que indivíduos com essa alteração cheguem à idade adulta sem uma intervenção42,43. A ACEOAP apresenta uma incidência de 1:300 000 nascidos vivos. Essa anomalia é um importante diagnóstico diferencial perante uma criança com insuficiência cardíaca e pode estar associada a outras malformações, como comunicação interauricular, interventricular ou coartação da aorta43,44.
Várias teorias têm sido descritas para explicar a origem de uma artéria coronária na artéria pulmonar, especificamente relacionadas com a divisão embriológica do truncus arteriosus. Assumindo que as artérias coronárias surgem como dois botões endoteliais, pode ocorrer a deslocação do local de origem de uma ou ambas as artérias coronárias para a região do truncus arterious que dará origem à artéria pulmonar. Outra possibilidade é a divisão anómala do truncus, pelo septo em desenvolvimento, e da qual resultará a incorporação de uma das origens das artérias coronárias na artéria pulmonar42.
Os doentes com ACEOAP geralmente apresentam sintomas precoces, habitualmente no primeiro ano de vida, com isquemia crónica e consequente insuficiência cardíaca. Os lactentes tipicamente têm dificuldades na alimentação, irritabilidade, diaforese, taquipneia e taquicardia e por vezes dor torácica, devido à isquemia do miocárdio. Se existir circulação colateral suficiente entre as duas artérias coronárias, os doentes podem ser assintomáticos durante a infância. Numa fase mais tardia, surgirá dispneia, dor torácica, síncope, intolerância ao exercício físico ou em última instância, morte súbita devido a isquemia aguda durante o exercício ou a arritmias ventriculares geradas a partir do tecido cicatricial miocárdico42.
Foram propostas quatro fases para explicar os sintomas e a progressão dessa anomalia43. No primeiro mês de vida, a hipertensão pulmonar fisiológica e a hemoglobina fetal fornecem a perfusão e oxigenação para o miocárdio, os indivíduos estão assintomáticos16,43. Posteriormente, numa segunda fase, pela diminuição da pressão pulmonar e dos níveis de oxigénio16,43, há muitas vezes uma descompensação, que leva a uma diminuição da perfusão coronária e isquemia da parede anterolateral. Essa isquemia é agravada durante a alimentação ou o choro, situações em que a necessidade de oxigénio é maior. A isquemia crónica, com consequente insuficiência cardíaca e associada a insuficiência mitral, pode ter repercussões no diagnóstico, com o surgimento de ondas QS nas derivações precordiais, dilatação ventricular esquerda e insuficiência mitral funcional, nos casos mais graves. Se essa fase for tolerada, então ocorrem alterações compensatórias e remodelação do miocárdio ao longo do tempo43. A terceira fase é tida como uma fase de sobrevivência até a idade adulta, na qual se desenvolvem colaterais intercoronárias, a partir da circulação direita, e que mantêm a perfusão do território da artéria coronária esquerda16,43. Nessa última fase, ocorre um shunt da artéria coronária direita, via colaterais, para a coronária esquerda43, cria‐se assim um sistema de maior pressão em relação à artéria pulmonar, inverte‐se o fluxo da artéria coronária esquerda anómala para a artéria pulmonar16. Esse é um exemplo do fenómeno de roubo coronário. Os doentes tornam‐se sintomáticos, podem apresentar dor torácica anginosa, fadiga, dispneia, palpitações, arritmias ventriculares, hipertensão pulmonar e morte súbita16,43. À medida que a idade avança, esses indivíduos adaptam‐se não só à isquemia crónica provocada pela artéria coronária esquerda anómala, mas também ao shunt entre o sistema arterial e venoso. Para além da formação de colaterais e da dominância da artéria coronária direita, ocorre estenose do óstio ou restrição da abertura da artéria coronária esquerda anómala na artéria pulmonar, diminui‐se o shunt, com consequente diminuição do roubo coronário. Por fim, desenvolvem‐se colaterais das artérias brônquicas para o miocárdio, o que aumenta a perfusão. As alterações no desenvolvimento dessas adaptações contribuem para a morbilidade e mortalidade, uma vez que a disfunção sistólica e dilatação do ventrículo esquerdo resultam de isquemia crónica do miocárdio45,46.
O ECG dos doentes portadores dessa anomalia pode mostrar evidência de isquemia ou enfarte da parede anterolateral (alterações do segmento ST, ondas Q em DI, aVL, V5 e V6). Contudo, 20 a 45% dos doentes não apresentam essas alterações29.
O diagnóstico dessa anomalia requer um grande índice de suspeição clínica, que no passado era confirmado por angiografia coronária42,43. Esse não se baseia apenas na observação da origem da artéria coronária esquerda na artéria pulmonar, mas também do fluxo retrógrado da coronária esquerda anómala para a artéria pulmonar. Atualmente, o ecocardiograma transtorácico permite observar essa característica tão sugestiva, confirma o diagnóstico e permite ver a origem da artéria, a dilatação da artéria coronária direita, a dilatação cardíaca com insuficiência cardíaca e insuficiência mitral associadas31,42,43. A ressonância magnética e a tomografia computorizada também são usadas para confirmar o diagnóstico, embora sejam particularmente importantes no seguimento pós‐operatório29.
O diagnóstico dessa anomalia congénita numa criança, gravemente doente, é indicação cirúrgica de urgência. Em crianças, o objetivo é restabelecer a perfusão coronária, preservar o miocárdio e permitir a recuperação da função ventricular esquerda. O tratamento definitivo padrão da ACEOAP é a reimplantação direta da artéria coronária na aorta, que restabelece o sistema coronário normal31,46,47. Nos casos em que essa técnica não é possível, existem técnicas alternativas, como a criação de um túnel intrapulmonar, que liga o óstio da artéria coronária anómala à aorta (técnica de Takeuchi)47.
As anomalias na origem da artéria coronária direita na artéria pulmonar são extremamente raras, com uma incidência de 0,002%. De 25 a 30% estão associados a outras anomalias cardíacas congénitas45. Essas alterações são assintomáticas em mais de 75% dos casos e sem evidência de isquemia do miocárdio. Estão descritos poucos casos de episódios de morte súbita cardíaca e insuficiência cardíaca11,29,48.
ConclusãoAs ACACs são um grupo heterogéneo de alterações congénitas raras, cujas manifestações são muito variáveis. Apesar de a maioria ser benigna, algumas são potencialmente graves, causam isquemia do miocárdio e morte súbita. A maioria dessas anomalias é assintomática, com exame físico sem alterações, requerer um alto índice de suspeição clínica.
A artéria coronária com origem no seio coronário oposto constitui uma importante entidade das ACACs, que mais se encontra associada à isquemia do miocárdio e em particular à morte súbita. A suspeição clínica deve ser alta, principalmente em indivíduos jovens com dor torácica, dispneia ou síncope relacionada com o exercício físico. O tratamento desse tipo de anomalias é um dos aspetos mais controversos, não existem ainda orientações clínicas oficiais, esse é um aspeto que devia ser alvo de maior investigação.
A natureza e idade de apresentação da ACEOAP são variáveis e dependentes da circulação colateral existente. Em crianças com sintomas de insuficiência cardíaca, alterações no ECG e diminuição da função sistólica do ventrículo esquerdo, deve‐se suspeitar dessa anomalia. O tratamento cirúrgico apresenta bons resultados mesmo nos doentes com disfunção ventricular esquerda grave e insuficiência mitral.
Devido às repercussões hemodinâmicas que essas anomalias apresentam, o seu diagnóstico e tratamento precoce são fundamentais.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.