Os cardioversores‐desfibrilhadores implantáveis (CDI) são ferramentas essenciais na prevenção de morte súbita. Requerem a utilização de acessos transversos com as inerentes complicações. O cardioversor‐desfibrilhador totalmente subcutâneo (CDI‐SC) pode prevenir algumas destas complicações.
ObjetivoAvaliação das terapêuticas e complicações associadas ao sistema.
População e métodosEm 23 doentes houve intenção de implantar CDI‐SC. As indicações foram: problemas com acesso vascular, risco de infeção aumentado ou jovens com previsão de prolongado tempo de seguimento. O dispositivo foi implantado em quatro doentes com cardiopatia isquémica, três deles em hemodiálise (dois destes doentes com trombose da veia subclávia). Em cinco jovens com ventrículo esquerdo não compactado, quatro com síndrome de Brugada, três com miocardiopatia arritmogénica do ventrículo direito, um com transposição dos grandes vasos, dois com miocardiopatia dilatada e quatro com miocardiopatia hipertrófica.
ResultadosFoi possível a implantação em 21 doentes. Dois doentes não apresentaram screening inicial do ECG de superfície compatível com vetores de desfibrilhação. O tempo médio de implantação foi 77 minutos, sem complicações. Foi efetuado teste de desfibrilhação; num dos doentes foi necessário reposicionar o gerador para obter um limiar aceitável.
Num seguimento médio de 14 meses, dez doentes apresentaram choques, sendo que em metade foram apropriados, um apresentou infeção do sistema, um teve necessidade de substituição precoce por perda de telemetria e um morreu por causa não cardíaca.
ConclusõesA implantação de CDI‐SC é passível de ser efetuada por cardiologistas, com taxa de sucesso elevada. A experiência inicial parece favorável, mas são necessários estudos adicionais com tempos de seguimento mais longos para avaliar a segurança e eficácia desta estratégia em comparação com a convencional.
Implantable cardioverter‐defibrillators (ICDs) are important tools in the prevention of sudden death, but implantation requires transvenous access, which is associated with complications. Subcutaneous implantable cardioverter‐defibrillators (S‐ICDs) may prevent some of these complications.
AimTo evaluate the therapeutics and complications associated with S‐ICD systems.
MethodsS‐ICD implantation was planned in 23 patients, for whom the indications were vascular access problems, increased risk of infection or young patients with long predicted follow‐up. The population consisted of four patients with ischemic heart disease, three of them on hemodialysis (two with subclavian vein thrombosis), five with left ventricular noncompaction, four with Brugada syndrome, three with arrhythmogenic right ventricular cardiomyopathy, one with transposition of the great vessels, two with dilated cardiomyopathy and four with hypertrophic cardiomyopathy.
ResultsS‐ICDs were implanted in 21 patients, two having failed to fulfil the initial screening criteria. Mean implantation time was 77 minutes, with no complications. Defibrillation tests were performed, and in one patient the generator had to be repositioned to obtain an acceptable threshold.
In a mean follow‐up of 14 months, 10 patients had S‐ICD shocks, which were appropriate in half of them; one developed infection, one needed early replacement due to loss of telemetry and one patient died of noncardiac cause.
ConclusionsS‐ICD implantation can be performed by cardiologists with a high success rate. Initial experience appears favorable, but further studies are needed with longer follow‐up times to assess the safety and efficacy of this strategy compared to conventional devices.
Os cardioversores‐desfibrilhadores implantáveis (CDI) são uma terapêutica eficaz na prevenção primária e secundária de morte súbita por arritmias ventriculares1–4. Desde que se implantou o primeiro CDI na década de 80, a sua evolução tecnológica e a facilidade de acesso motivou um alargamento das suas indicações clínicas, estando estas bem explícitas em recomendações de prevenção de morte súbita, de dispositivos cardíacos e de insuficiência cardíaca da Sociedade Europeia de Cardiologia1,3.
Estes dispositivos utilizam um ou mais elétrodos que, por acesso transvenoso, se implantam nas cavidades cardíacas5. O elo mais fraco dos dispositivos são os elétrodos transvenosos, com problemas associados à sua implantação (trombose do acesso utilizado), longevidade, infeção, fratura, bem como problemas agudos na implantação: pneumotórax, hemotórax e tamponamento cardíaco6. Muitas vezes, estas complicações são responsáveis por terapêuticas inapropriadas ou incapacitam as apropriadas e resultam em novas intervenções para substituição do sistema implantado. Assim, apesar do avanço tecnológico dos geradores e eletrocateteres nas últimas décadas, a utilização de acessos transvenosos para a implantação dos CDI implica uma elevada taxa de morbilidade6.
Recentemente foi desenvolvido um sistema de desfibrilhação totalmente extravascular criado com o objetivo de reduzir a morbilidade associada ao uso de elétrodos transvenosos. O presente estudo descreve a nossa experiência com a utilização deste dispositivo, em 21 doentes com seguimento médio superior a um ano.
População e métodosDe um total de 1167 doentes que implantaram cardioversor desfibrilhador, para prevenção primária ou secundária, no nosso centro entre dezembro de 2008 e janeiro de 2013, em 21 foi implantado cardioversor‐desfibrilhador subcutâneo (CDI‐SC).
A seleção foi feita com base no eventual benefício do sistema. Assim, os candidatos foram doentes jovens com alta probabilidade de virem a necessitar de substituição do sistema e doentes com acesso vascular dificultado e/ou elevado risco de infeção.
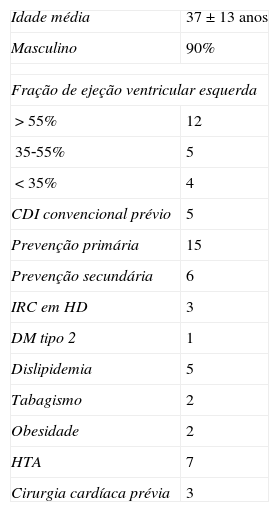
Num total de 23 doentes houve intenção de implantar CDI‐SC. Dois doentes falharam o teste de screening inicial, um com o diagnóstico de síndrome de Brugada e outro com miocárdio não compactado, pelo que se implantou CDI‐SC em 21 doentes. A média de idades foi 37+/–13 anos e 19 doentes eram do sexo masculino. Os fatores de risco cardiovascular eram hipertensão arterial, diabetes tipo 2, obesidade, tabagismo e dislipidemia distribuídos conforme indicado na Tabela 1.
Características demográficas da população
| Idade média | 37±13 anos |
| Masculino | 90% |
| Fração de ejeção ventricular esquerda | |
| >55% | 12 |
| 35‐55% | 5 |
| <35% | 4 |
| CDI convencional prévio | 5 |
| Prevenção primária | 15 |
| Prevenção secundária | 6 |
| IRC em HD | 3 |
| DM tipo 2 | 1 |
| Dislipidemia | 5 |
| Tabagismo | 2 |
| Obesidade | 2 |
| HTA | 7 |
| Cirurgia cardíaca prévia | 3 |
A maioria dos doentes apresentava fração de ejeção preservada, em seis doentes o CDI‐SC foi implantado como prevenção secundária, cinco eram portadores de CDI convencional (substituição por endocardite e fratura de elétrodo) e três tinham sido submetidos previamente a cirurgia cardíaca (revascularização miocárdica, correção de transposição de grandes vasos e cirurgia de Morrow, em doente com miocardiopatia hipertrófica).
O dispositivo foi implantado em quatro doentes com cardiopatia isquémica, três deles insuficientes renais crónicos em hemodiálise (dois destes doentes com trombose da veia subclávia) por aumento do risco infecioso e outro com infeção do sistema convencional previamente implantado. Em quatro jovens com o diagnóstico clínico de ventrículo esquerdo não compactado e história de taquicardia ventricular (TV) não mantida no Holter ou prova de esforço, síncope ou história familiar de morte súbita (todos com diagnóstico ecocardiográfico confirmado por ressonância magnética). Em três jovens adultos com síndrome de Brugada, três com miocardiopatia arritmogénica do ventrículo direito (MAVD), um com transposição dos grandes vasos, dois com miocardiopatia dilatada e quatro doentes com miocardiopatia hipertrófica (MCH), um deles previamente submetido a cirurgia cardíaca com história familiar de morte súbita na família, também implantaram CDI‐SC (Tabela 2).
‐21 doentes submetidos a implantação do dispositivo
| Idade | Patologia | Tempo implantação (m) | CDI prévio | Prevenção primária | Choques apropriados | Choques inapropriados | TV | FV | Tempo até ao choque (s) |
| 37 | Brugada | 60 | N | S | N | N | |||
| 34 | Brugada | 60 | N | S | N | N | |||
| 46 | Brugada | 100 | S | S | N | N | |||
| 31 | DAVD | 69 | S | N | S | N | S | 13 | |
| 18 | DAVD | 59 | N | N | S | N | S | 12 | |
| 21 | DAVD | 60 | N | S | N | S | |||
| 61 | Isquémica | 70 | N | N | S | N | S | S | 16 |
| 48 | Isquémica | 75 | N | N | S | N | S | 13 | |
| 65 | Isquémica | 61 | S | S | N | N | |||
| 56 | Isquémica | 47 | N | S | N | N | |||
| 72 | MCD | 68 | N | N | N | N | |||
| 42 | MCD | 61 | N | S | N | N | |||
| 21 | MCH | 120 (1a implantação) | S | S | N | S | |||
| 23 | MCH | 57 | N | S | N | S | |||
| 23 | MCH | 63 | N | S | N | N | |||
| 36 | MCH | 55 | N | S | N | N | |||
| 17 | Não compactação | 80 | N | S | S | N | S | 14 | |
| 27 | Não compactação | 90 | N | S | N | N | |||
| 17 | Não compactação | 53 | N | S | N | S | |||
| 25 | Não compactação | 80 | N | S | N | N | |||
| 57 | TGV | 100 (com PMD epicárdico) | S | N | N | S |
FV: fibrilhação ventricular MAVD: miocardiopatia arritmogénica do ventrículo direito; MCD: miocardiopatia dilatada; MCH: miocardiopatia hipertrófica; TGV: transposição dos grandes vasos; TV: taquicardia ventricular.
Tal como acontece com a colocação de CDI convencional, todos os doentes foram admitidos no próprio dia do procedimento tendo alta hospitalar no dia seguinte. A medicação previamente instituída em consulta, incluindo hipocagulação no caso de apresentar níveis terapêuticos (um doente sob varfarina), não foi alterada e o tempo médio do procedimento foi de 77+/‐14 minutos.
Todos os dispositivos foram implantados na sala de eletrofisiologia e pacing com exceção de um caso que necessitou de pacemaker epicárdico, que foi colocado no bloco operatório com apoio da cirurgia cardiotorácica.
O sistema CDI‐SC (SQ RX 1010 Cameron Health®) é constituído por um gerador e um elétrodo tripolar que regista a atividade elétrica do coração. Este conjunto projeta três vetores de condução elétrica originando por isso três vetores de sensing, um primário, um secundário e outro alternativo. O algoritmo de deteção de taquicardia utiliza a frequência cardíaca e a morfologia dos complexos QRS. Se a frequência cardíaca for superior à mínima programada para deteção, análises de certificação baseadas na morfologia do complexo QRS avaliam necessidade de terapia. A terapia consiste em até cinco choques de 80J com possibilidade pacing transtorácico pós choque durante 30 segundos.
Todos os doentes são previamente submetidos a um screening inicial em que um (eletrocardiograma) ECG de superfície com derivações nas zonas correspondentes aos polos do CDI‐SC é avaliado com uma régua apropriada que avalia a amplitude e duração do QRS e onda T, de modo a avaliar a probabilidade de dupla contagem.
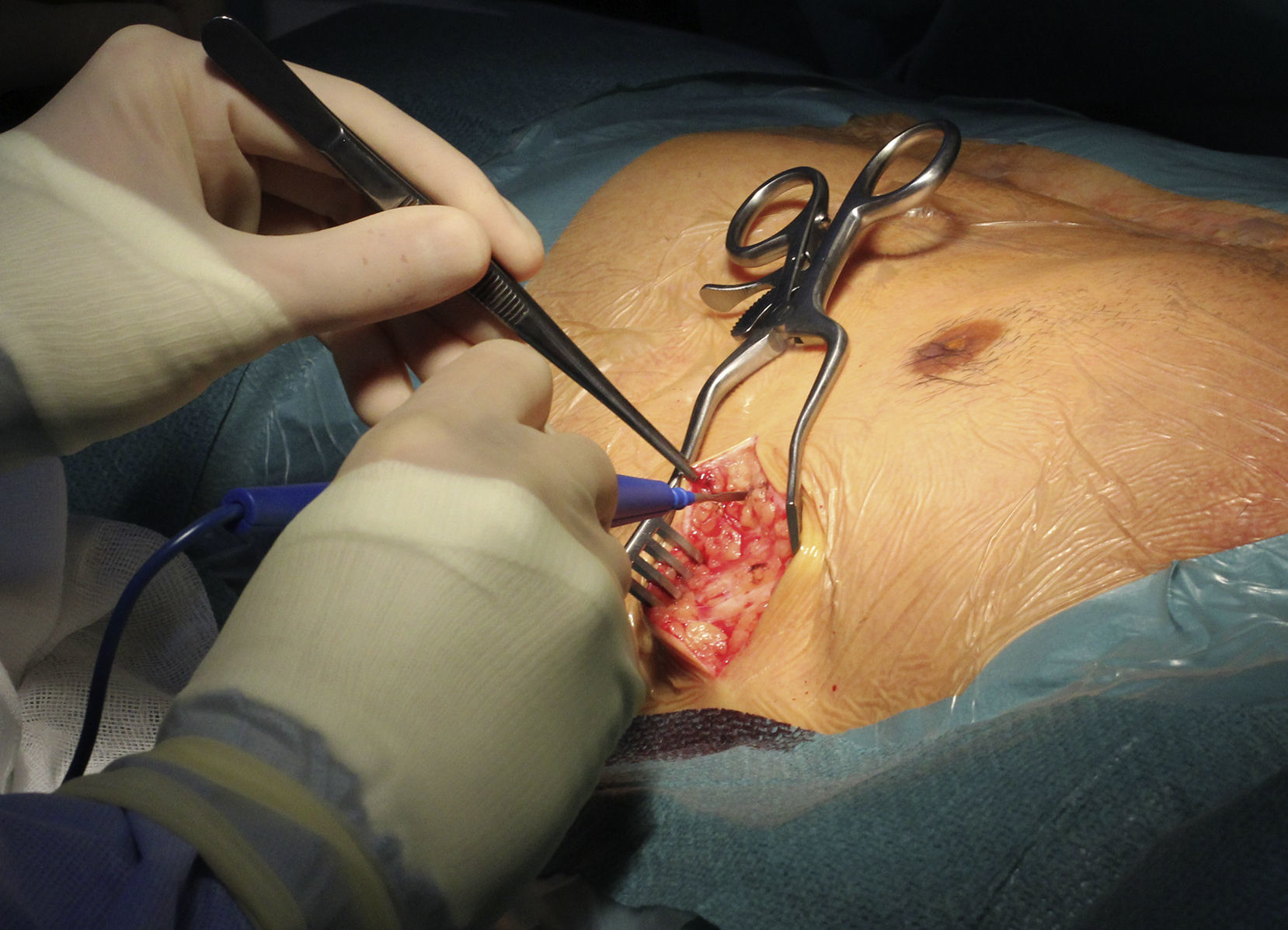
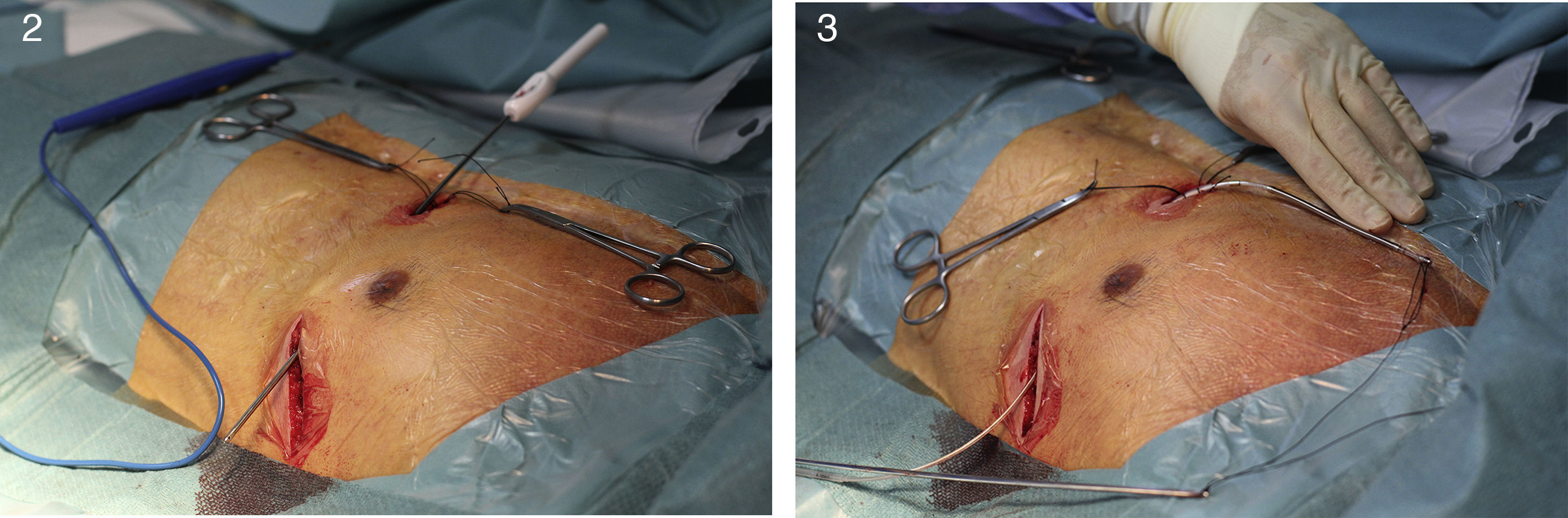
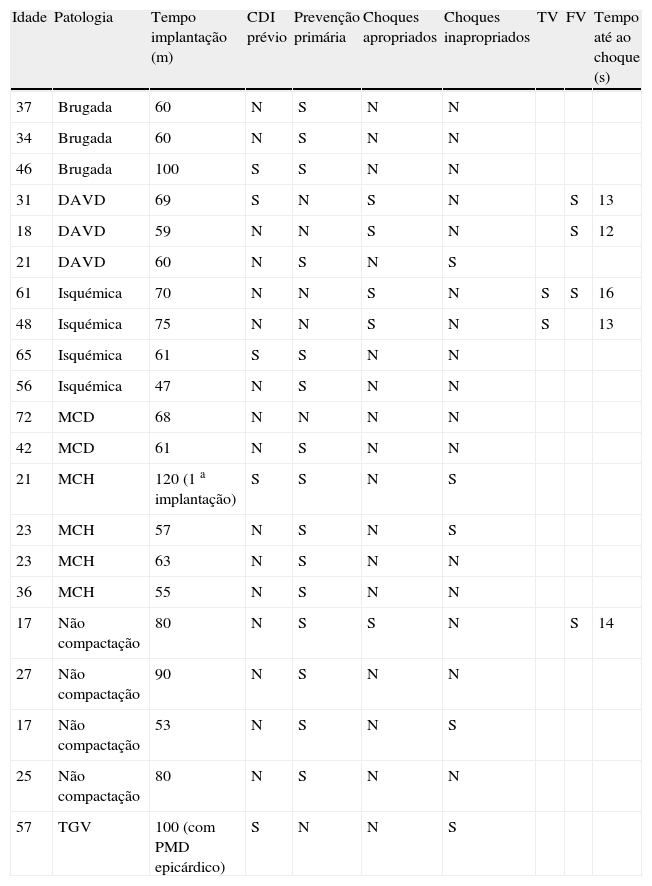
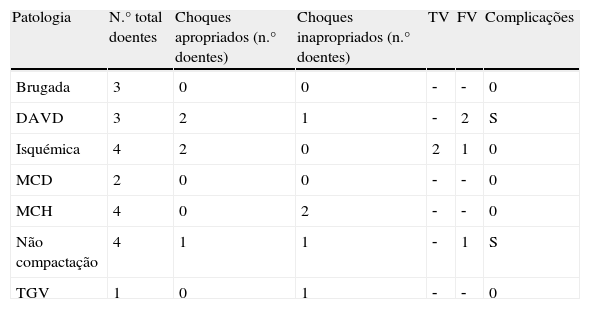
A implantação do dispositivo não necessita de fluoroscopia, baseando‐se em critérios anatómicos e efetua‐se com um protocolo de sedoanestesia (propofol 2mg/kg/h e remifentanil 0,2μg/kg/min) e profilaxia antibiótica (ceftriaxona). A loca do gerador é criada na linha média axilar esquerda no sexto espaço intercostal (Figura 1). O elétrodo desfibrilhador é colocado adjacente ao bordo esquerdo do esterno. Após uma incisão inicial no apêndice xifóideo procede‐se à tunelização do elétrodo para a loca do gerador e, depois, para a fúrcula esternal (Figuras 2,3). Em todos os doentes foi realizado teste de desfibrilhação com 65J imediatamente após a colocação do sistema.
Em nenhum doente se verificaram complicações relacionadas com o procedimento.
Após implantação, os doentes foram observados antes da alta hospitalar (tendo efetuado RX de tórax de controlo) e ao fim do primeiro, terceiro, sexto e décimo segundo mês após alta hospitalar, ou sempre que tivessem terapias do aparelho.
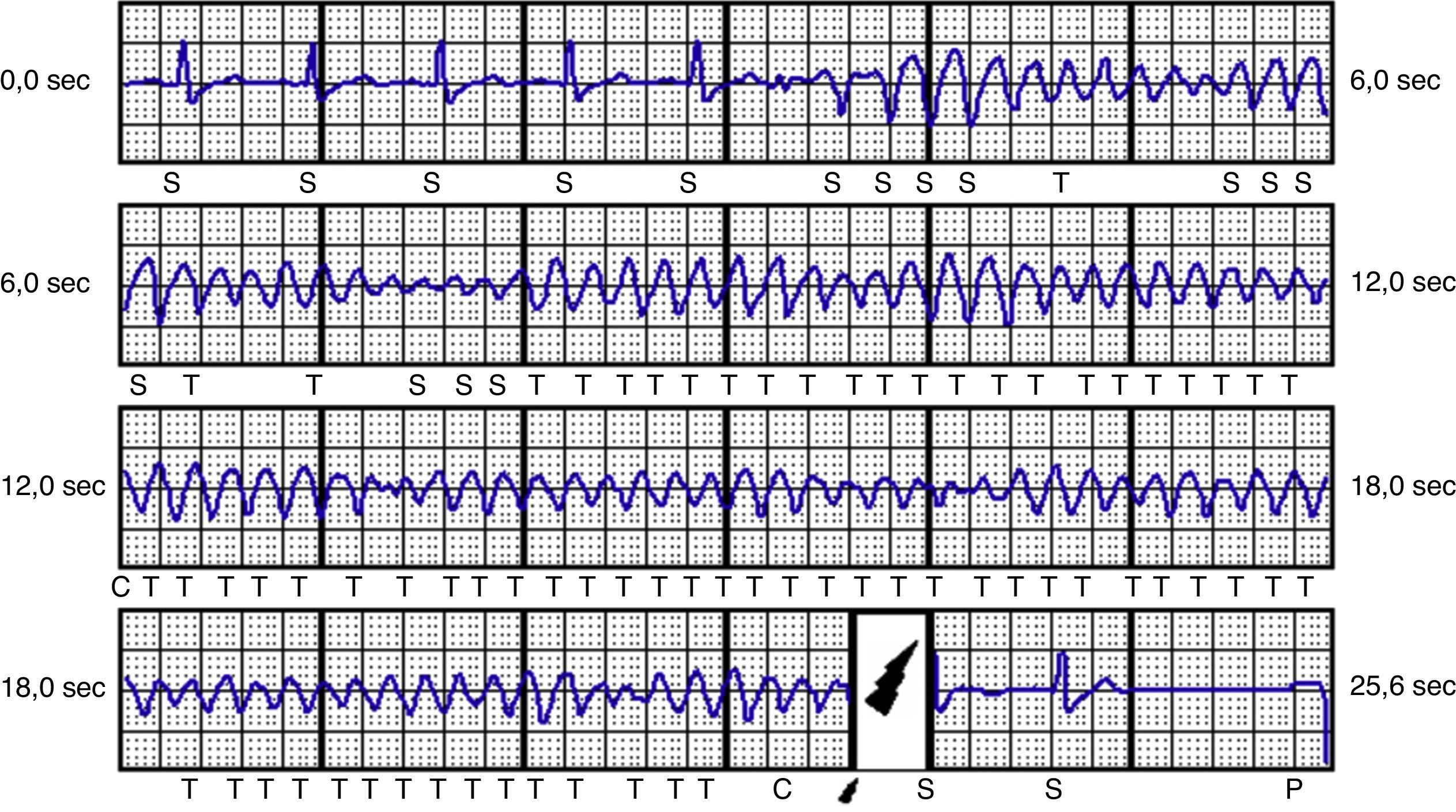
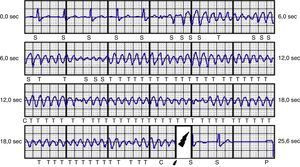
ResultadosNum seguimento médio de 14 meses, num doente, por falhar o teste de desfibrilhação, houve necessidade de reposicionamento do gerador. Num dos doentes com MAVD, após choque apropriado no próprio dia da colocação do dispositivo, há a referir como intercorrência a incapacidade de comunicação por telemetria com o aparelho após terapia apropriada. Situação analisada pela companhia que formalizou um advisory notice onde relatou três casos na Europa por um problema relacionado com a bateria do gerador resolvido com um upgrade de software, não se registando novos casos desde então. Neste último doente procedeu‐se à substituição por um sistema convencional no dia seguinte por ter sido interrompida implantação dos dispositivos subcutâneos no centro até clarificação do fabricante para sucedido. O doente mais idoso da série que implantou CDI‐SC (72 anos) por MCD idiopática e trombose da veia subclávia faleceu por causa não vascular (sépsis em que o agente isolado foi Clostridium difficile), não se registando episódios até à data do óbito. Cinco doentes apresentaram choques inapropriados, dois por taquicardia sinusal durante atividade desportiva e três por oversensing da onda T, tendo sido necessário alterar a programação para o vetor secundário (sem registo de novas terapias desde a alteração). Dois doentes com cardiopatia isquémica e insuficiência renal crónica em hemodiálise apresentaram episódios de TV e FV (fibrilhação ventricular) (Figura 4), tendo sido tratados com sucesso com choques apropriados (o doente com TV foi posteriormente submetido a ablação de TV não se registando nenhum episódio após procedimento). Dois doentes com MAVD e outro com o diagnóstico de não compactação do ventrículo esquerdo apresentaram também terapias apropriadas por FV (Tabelas 2 e 3).
Número de choques por arritmias na população com CDI‐SC
| Patologia | N.° total doentes | Choques apropriados (n.° doentes) | Choques inapropriados (n.° doentes) | TV | FV | Complicações |
| Brugada | 3 | 0 | 0 | ‐ | ‐ | 0 |
| DAVD | 3 | 2 | 1 | ‐ | 2 | S |
| Isquémica | 4 | 2 | 0 | 2 | 1 | 0 |
| MCD | 2 | 0 | 0 | ‐ | ‐ | 0 |
| MCH | 4 | 0 | 2 | ‐ | ‐ | 0 |
| Não compactação | 4 | 1 | 1 | ‐ | 1 | S |
| TGV | 1 | 0 | 1 | ‐ | ‐ | 0 |
FV: fibrilhação ventricular; MAVD: miocardiopatia arritmogénica do ventrículo direito; MCD: miocardiopatia dilatada; MCH: miocardiopatia hipertrófica; TGV: transposição dos grandes vasos; TV: taquicardia ventricular.
Nos cinco doentes portadores de CDI convencional os motivos que provocaram a substituição pelo dispositivo subcutâneo foram endocardite do sistema em dois casos e fratura de elétrodo nos restantes três doentes.
Não se verificaram complicações agudas relacionadas com o procedimento nomeadamente deslocação ou fratura de elétrodo.
DiscussãoComo comprovado após vários ensaios e meta‐análises, a implantação de CDI está indicada nos doentes com elevado risco de morte súbita7–9. Apesar disso, têm vindo a ser descritos cada vez mais problemas relacionados com a implantação e utilização destes dispositivos, quer mecânicas quer de programação10,11. Endocardite, hemorragia, trombose venosa ou pneumotórax são algumas das possíveis complicações6,10. Os problemas relacionados com elétrodos transvenosos como fratura, deslocamento ou aumento dos limiares são frequentes e aumentam ao longo do tempo apresentando as séries mais otimistas apenas 80% de elétrodos funcionantes dez anos após implantação10. No sentido de minimizar esses riscos, é essencial considerar sistemas cuja implantação seja menos invasiva e a sua substituição facilitada.
Com o CDI‐SC o risco de complicações vasculares é reduzido12, o que possibilita a sua utilização em doentes com cardiopatias congénitas, lesões trombóticas extensas ou com predisposição para infeções. Este método ganha ainda mais importância no caso dos doentes descritos com CDI convencional previamente implantado que apresentaram complicações relacionadas com o sistema vascular ou infeção. O aparelho não limita os movimentos dos membros superiores e apresenta uma rápida recuperação após implantação sendo assim mais adequado a jovens com elevada atividade física. O aparelho é dotado de boa capacidade de leitura e discriminação arrítmica do ECG, sendo que o estudo START demonstrou 100% de sensibilidade na deteção de FV13.
As principais desvantagens e limitações são a não possibilidade de pacing antibradicardia e antitaquicardia. Por esta razão, na seleção de doentes foram excluídos aqueles em que se verificou bradicardia sinusal sintomática, bloqueio auriculoventricular de qualquer grau ou TV monomórfica com alta probabilidade de resposta a pacing antitaquicardia. Na série apresentada, apenas dois choques apropriados (em dois doentes diferentes) se deveram a TV (todos os restantes foram por FV) e ambos os doentes tinham cardiopatia isquémica. As referidas limitações tornam‐se relativas quando a população alvo para a implantação do CDI‐SC são doentes em idade pediátrica ou jovens adultos cujas patologias apresentam como principal arritmia a FV ou TV de frequência muito elevada com baixa probabilidade de responder eficazmente ao pacing antitaquicardia. O gradiente de voltagem dos choques entregues pelo CDI‐SC é mais homogéneo em comparação com o sistema convencional (4V/cm versus 30V/cm respetivamente) estando por isso as terapias associadas a menor elevação dos valores de troponina e menor depressão da contratilidade14. No caso dos doentes que necessitam desfibrilhador como prevenção primária, confirmada a vantagem da utilização de uma só zona de terapias de elevada frequência15, as indicações para a implantação do CDI‐SC poderão ser alargadas no futuro. Para além disso, a limitação da incapacidade de pacing pode ser ultrapassada com a implantação de pacemaker epicárdico ou mesmo transvenoso16. No doente com cardiopatia congénita complexa (TGV), após extração de CDI convencional por endocardite foi implantado CDI‐SC com pacemaker epicárdico adicional sem intercorrências.
ConclusãoNa nossa experiência, o CDI‐SC para ser uma alternativa eficaz e segura ao desfibrilhador transvenoso.
A utilização mais alargada deste dispositivo virá a determinar no futuro se pode ser aplicado a todos os doentes com indicação para CDI ou se ficará reservado para doentes selecionados.
A implantação de CDI‐SC é passível de ser efetuada por cardiologistas, com taxa de sucesso elevada e com tempos de implantação comparáveis aos descritos para os CDI convencionais.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos do seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.